You are looking for information, articles, knowledge about the topic nail salons open on sunday near me 소금물 농도 문제 on Google, you do not find the information you need! Here are the best content compiled and compiled by the https://toplist.pilgrimjournalist.com team, along with other related topics such as: 소금물 농도 문제 소금물 농도 문제 pdf, 소금물 의 농도 에 대한 문제, 소금물 문제 유형, 소금물 농도 구하기, 소금물 문제 푸는법, 소금물 소금 추가, 소금물 농도 쉽게, 소금물 농도 단위
Table of Contents
소금물 농도 문제::::수학과 사는 이야기
- Article author: suhak.tistory.com
- Reviews from users: 15678
Ratings
- Top rated: 5.0
- Lowest rated: 1
- Summary of article content: Articles about 소금물 농도 문제::::수학과 사는 이야기 딸아이가 드디어 소금물 문제를 풀기 시작했다. 소금물 농도 문제는 중학교 2학년을 괴롭힌다. 사실 따지고 보면 미지수가 하나인 일차방정식에 … …
- Most searched keywords: Whether you are looking for 소금물 농도 문제::::수학과 사는 이야기 딸아이가 드디어 소금물 문제를 풀기 시작했다. 소금물 농도 문제는 중학교 2학년을 괴롭힌다. 사실 따지고 보면 미지수가 하나인 일차방정식에 … 딸아이가 드디어 소금물 문제를 풀기 시작했다. 소금물 농도 문제는 중학교 2학년을 괴롭힌다. 사실 따지고 보면 미지수가 하나인 일차방정식에 지나지 않는 아주 쉬운 문제지만 처음 만나면 만만치 않다. 농도에..고등학교 수학, 미적분학, calculus, 면접, HTML, CSS, tistoryskin, Mathmatics, 여행, 사진, 야생화, 수학, 스킨
- Table of Contents:
소금물 농도 문제
Table of concentrations and related quantities
티스토리툴바
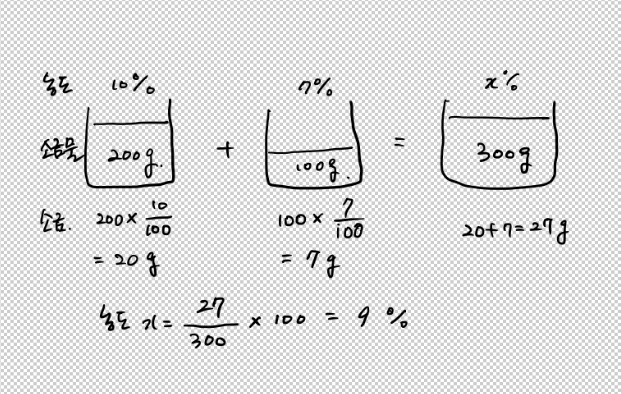
[일차방정식의 활용] 소금물 농도 문제 – 그림 하나로 다 해결된다. : 네이버 블로그
- Article author: m.blog.naver.com
- Reviews from users: 39085
Ratings
- Top rated: 3.4
- Lowest rated: 1
- Summary of article content: Articles about [일차방정식의 활용] 소금물 농도 문제 – 그림 하나로 다 해결된다. : 네이버 블로그 소금물농도 문제는 출제자가 일부러 꼬아내려고 작정을 하지 않는 한 농도를 퍼센트(%, 백분율)로 나타냅니다. 퍼센트(%) 계산은 어렵지 않죠? 20% 할인 … …
- Most searched keywords: Whether you are looking for [일차방정식의 활용] 소금물 농도 문제 – 그림 하나로 다 해결된다. : 네이버 블로그 소금물농도 문제는 출제자가 일부러 꼬아내려고 작정을 하지 않는 한 농도를 퍼센트(%, 백분율)로 나타냅니다. 퍼센트(%) 계산은 어렵지 않죠? 20% 할인 …
- Table of Contents:
카테고리 이동
깔끔수학 – 수학읽기·수학쓰기
이 블로그
중 1
카테고리 글
카테고리
이 블로그
중 1
카테고리 글
![[일차방정식의 활용] 소금물 농도 문제 - 그림 하나로 다 해결된다. : 네이버 블로그](https://blogthumb.pstatic.net/20150616_167/nowedu1_14343943378183AECm_JPEG/%BC%D2%B1%DD%B9%B0%B3%F3%B5%B5_%BA%F1%C0%CC%C4%BF_11.jpg?type=w2)
중1수학 농도 문제
- Article author: ywpop.tistory.com
- Reviews from users: 8823
Ratings
- Top rated: 4.1
- Lowest rated: 1
- Summary of article content: Articles about 중1수학 농도 문제 중1수학 농도 문제. 무게 퍼센트(%) 농도의 정의는 (A)식과 같다. (여기서, 소금물의 양 = 소금의 양 + 물의 양). 예) 소금 20 g이 들어있는 소금물의 … …
- Most searched keywords: Whether you are looking for 중1수학 농도 문제 중1수학 농도 문제. 무게 퍼센트(%) 농도의 정의는 (A)식과 같다. (여기서, 소금물의 양 = 소금의 양 + 물의 양). 예) 소금 20 g이 들어있는 소금물의 … 중1수학 농도 문제 무게 퍼센트(%) 농도의 정의는 (A)식과 같다. (여기서, 소금물의 양 = 소금의 양 + 물의 양) 예) 소금 20 g이 들어있는 소금물의 양이 500 g이라면, 이 소금물의 농도는? (A)식을 소금의 양에..
- Table of Contents:
관련글
댓글0
공지사항
최근댓글
전체 방문자
티스토리툴바

소금물의 농도 :: 수학공부
- Article author: silverstonec.tistory.com
- Reviews from users: 29018
Ratings
- Top rated: 3.1
- Lowest rated: 1
- Summary of article content: Articles about 소금물의 농도 :: 수학공부 문제1). 물 200g에 소금 40g을 녹이면 농도는? 문제2). 20%의 소금물 300g에 녹아있는 소금의 양은? 소금의 양을 구하는 공식을 외웠으면. 문제3). …
- Most searched keywords: Whether you are looking for 소금물의 농도 :: 수학공부 문제1). 물 200g에 소금 40g을 녹이면 농도는? 문제2). 20%의 소금물 300g에 녹아있는 소금의 양은? 소금의 양을 구하는 공식을 외웠으면. 문제3). 위의 공식만으로도 충분(?)하지만 굳이 하나 더 외우고 싶으면 문제1) 물 200g에 소금 40g을 녹이면 농도는? 문제2) 20%의 소금물 300g에 녹아있는 소금의 양은? 소금의 양을 구하는 공식을 외웠으면 문제3)..수학공부
- Table of Contents:
소금물의 농도
티스토리툴바
[¿Û] ¼öÇп¡¼ ³óµµ °è»ê¿¡´Â ¿Ö ¼Ò±Ý¹°ÀÌ ³ª¿Ã±î?(¿µ»ó) – ±¹¹ÎÀϺ¸
- Article author: m.kmib.co.kr
- Reviews from users: 28746
Ratings
- Top rated: 4.4
- Lowest rated: 1
- Summary of article content: Articles about [¿Û] ¼öÇп¡¼ ³óµµ °è»ê¿¡´Â ¿Ö ¼Ò±Ý¹°ÀÌ ³ª¿Ã±î?(¿µ»ó) – ±¹¹ÎÀϺ¸ 푸는 원리는 이렇다. 물을 증발시켜도 소금의 양은 양쪽이 같다고 보면된다. 증발시키는 물의 양을 x라고 할 때 ‘4/100*소금물 200g= … …
- Most searched keywords: Whether you are looking for [¿Û] ¼öÇп¡¼ ³óµµ °è»ê¿¡´Â ¿Ö ¼Ò±Ý¹°ÀÌ ³ª¿Ã±î?(¿µ»ó) – ±¹¹ÎÀϺ¸ 푸는 원리는 이렇다. 물을 증발시켜도 소금의 양은 양쪽이 같다고 보면된다. 증발시키는 물의 양을 x라고 할 때 ‘4/100*소금물 200g= …
- Table of Contents:
°øÀ¯Çϱâ
Àα⠱â»ç
¸¹ÀÌ º» ±â»ç
¿µ»ó
Æ÷Åä
¾ÆÁ÷ »ì¸¸ÇÑ ¼¼»ó
![[¿Û] ¼öÇп¡¼ ³óµµ °è»ê¿¡´Â ¿Ö ¼Ò±Ý¹°ÀÌ ³ª¿Ã±î?(¿µ»ó) - ±¹¹ÎÀϺ¸](https://image.kmib.co.kr/online_image/2022/0404/2022040413270556002_1649046425_0016938409.jpg)
See more articles in the same category here: https://toplist.pilgrimjournalist.com/blog.
수학과 사는 이야기
반응형
딸아이가 드디어 소금물 문제를 풀기 시작했다. 소금물 농도 문제는 중학교 2학년을 괴롭힌다. 사실 따지고 보면 미지수가 하나인 일차방정식에 지나지 않는 아주 쉬운 문제지만 처음 만나면 만만치 않다. 농도에도 여러 가지가 있지만 중학교 수학 문제는 모두 질량 농도를 백분율(%)로 나타내고 있다. 굳이 왜 백분율을 쓰는지 모르겠지만 이게 학생을 헷갈리게 만든다.
질량 농도는 용액 100mL에 녹아 있는 성분이 몇 g인가를 나타낸 값이다. 맨 아래 표에서 단위를 보면 쉽게 알 수 있다.
서론이 길었다. 소금물 문제를 쉽게 해결하는 방법을 찾아보자. 아래 두 가지를 꼭 기억하자.
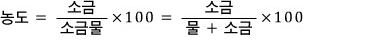
1. 소금물$=$소금$+$물
2. 소금물의 양$\times$농도(%)$\div 100=$소금의 양
소금물에 있는 소금의 양을 계산하려면 반드시 백분율을 분수로 나타내야 한다. 더 어렵게 설명하고 싶지만 이글은 중학생을 위한 글이므로 참는다. 소금물 문제는 당연히 구하고자 하는 값을 $x$로 두고 단계별로 소금물의 양과 소금의 양을 따로 계산해 두면 끝이다. 익숙해지기 전까지는 그림을 그려 보자.
문제를 보자.
1. 농도가 10%인 소금물 200g과 농도가 7%인 소금물 100g을 섞어서 만든 소금물은 농도가 얼마인가?
가장 간단한 문제이다. 소금의 양만 잘 계산하면 간단히 해결
2. 농도가 10%인 소금물 200g에 물을 넣어서 농도가 5%인 소금물을 만들려고 한다. 이 때 몇 g의 물을 더 넣어야 하는지 구하시오.
미지수가 중간으로 옮겨져 살짝 복잡해 보이지만 그래도 간단히 해결
3. 농도가 10%인 소금물 200g에 농도가 15%인 소금물을 섞어서 13%인 소금물을 만들려고 한다. 이 때 15%인 소금물은 몇 g 넣어야 하는지 구하시오.
슬슬 복잡한 느낌이 들어서 귀찮은 문제지만 일차방정식쯤이야
4. 농도가 10%인 소금물 200g에서 50g을 덜어내고 물을 넣어서 농도가 5%인 소금물을 만들려고 한다. 이 때 몇 g의 물을 더 넣어야 하는지 구하시오.
문제를 만들기 위한 문제다. 한꺼풀 벗겨내면 위에 있는 문제들과 크게 다르지 않다.
왜 이런 문제가 교과서에 있을까? 우리 딸 말대로 쓸모라고는 없어 보인다. 앞에 앉은 화학 선생님께 물어 보았다. 화학 실험에서 농도를 모르는 용액은 많지 않다고 한다. 왜냐하면 농도를 모르면 측정하기 매우 어렵기 때문이다. 그러니 화학시간에도 이 문제는 쓸모가 별로 없다. 하지만 농도를 알고 있는 용액을 섞어서 필요한 농도를 가진 용액을 만들어야 하는 경우는 자주 있다고 한다. 그러니 첫 번째 문제 정도는 알고 있으면 좋겠다.
위키피디아 농도
Table of concentrations and related quantities
Concentration type Symbol Definition SI unit other unit(s) mass concentration ρ i {\displaystyle \rho _{i}} or γ i {\displaystyle \gamma _{i}} m i / V {\displaystyle m_{i}/V} kg/m3 g/100mL (= g/dL) molar concentration c i {\displaystyle c_{i}} n i / V {\displaystyle n_{i}/V} mol/m3 M (= mol/L) number concentration C i {\displaystyle C_{i}} N i / V {\displaystyle N_{i}/V} 1/m3 1/cm3 volume concentration ϕ i {\displaystyle \phi _{i}} V i / V {\displaystyle V_{i}/V} m3/m3 Related quantities Symbol Definition SI unit other unit(s) normality c i / f e q {\displaystyle c_{i}/f_{\mathrm {eq} }} mol/m3 N (= mol/L) molality b i {\displaystyle b_{i}} n i / m s o l v e n t {\displaystyle n_{i}/m_{\mathrm {solvent} }} mol/kg mole fraction x i {\displaystyle x_{i}} n i / n t o t {\displaystyle n_{i}/n_{\mathrm {tot} }} mol/mol ppm, ppb, ppt mole ratio r i {\displaystyle r_{i}} n i / ( n t o t − n i ) {\displaystyle n_{i}/(n_{\mathrm {tot} }-n_{i})} mol/mol ppm, ppb, ppt mass fraction w i {\displaystyle w_{i}} m i / m t o t {\displaystyle m_{i}/m_{\mathrm {tot} }} kg/kg ppm, ppb, ppt mass ratio ζ i {\displaystyle \zeta _{i}} m i / ( m t o t − m i ) {\displaystyle m_{i}/(m_{\mathrm {tot} }-m_{i})} kg/kg ppm, ppb, ppt
반응형
[일차방정식의 활용] 소금물 농도 문제 – 그림 하나로 다 해결된다.
[일차방정식의 활용] 소금물 농도 문제 – 그림 하나로 다 해결된다. [일차방정식의 활용 문제] 소금물 농도 문제 – 그림을 이용하면 다 해결된다.소금물농도 문제는 출제자가 일부러 꼬아내려고 작정을 하지 않는 한 농도를 퍼센트(%, 백분율)로 나타냅니다.
퍼센트(%) 계산은 어렵지 않죠?
20% 할인하는 곳에서 1000원짜리 물건을 사면 200원을 할인받습니다.
40명의 학생 중 25%는,
그러면, 소금물 200g에 녹아있는 소금의 농도를 10%라고 하면
소금물에 있는 소금의 양은
이 됩니다.
농도 문제에서는 편의상 으로 나타냅니다. (농도) × (소금물의 양)
방정식은 등식이며 이는 등호(=)로 나타내어지는 식을 말합니다.
즉, 좌변=우변이 되며 좌변과 우변의 값 뿐 만 아니라 단위, 차원까지도 같아야합니다.
소금물의 농도 문제에서는 위에서 말한 ‘소금의 양’으로 등식을 세웁니다.
등식(방정식)을 세우는 방법 – 그림을 이용
예제를 통해 설명하도록 하겠습니다.
[유형1] 농도가 다른 두 소금물을 섞는 경우10%의 소금물 400g과 16%의 소금물을 섞어 14%의 소금물을 만들었다. 이 때, 16%의 소금물의 양을 구하시오.
문제를 풀기 전에 이 상황을 이해해야하는데 이 때 그림을 이용합니다.
(아래 그림에서 ‘+’는 소금물의 용량이 늘어나면 ‘+’, 용량이 줄어들면 ‘-‘입니다.)
16%의 소금물의 양을 이라고 하면,
양변 ×100을 하면,
∴ 800g
[소금물 농도 공식]이 그림을 이용한 풀이과정이 익숙해지면 조금 더 빠른 계산이 가능합니다.
대부분의 문제에서 농도는 항상 %로 주어지므로 (혹시, 할푼리 등으로 주어지더라도 어차피 같기 때문에)
다음과 같이 간단하게 식을 세울수가 있습니다.
즉, 바로
과 같이 간단한 식으로 나타낼 수 있습니다.
(단, 서술형에서는 원래대로 적어주는게 좋겠죠? ^^)
이제 다른 유형들도 다뤄보겠습니다.
[유형2] 물을 넣거나 증발시키는 경우6%의 소금물 450g이 있다. 여기에서 몇 g의 물을 증발시키면 9%의 소금물이 되는지 구하시오.
물의 농도는??? 0%입니다. ^^
이 상황의 그림은 아래와 같겠죠?
물을 증발시키는 경우, 소금물의 용량이 줄어들기 때문에 ‘-‘가 됩니다.
∴ 150g
소금물 160g에 물 40g을 넣었더니 농도가 8%인 소금물이 되었다. 처음 소금물의 농도를 구하여라.
∴ 10 %
[유형3] 소금을 더 넣는 경우10%의 소금물 200g이 있다. 여기에서 몇 g의 소금을 더 넣으면 20%의 소금물이 되는지 구하시오.
이 경우 소금의 농도는? 10 0%입니다.
∴ 25g
[유형4] 살짝 고난도 ^^12%의 소금물300g에서 소금물을 조금 퍼내고, 퍼낸 소금물 만큼의 물을 부은 후 6%의 소금물을 섞어서 8%의 소금물 450g을 만들었다. 퍼낸 소금물의 양을 구하시오.
조금 어렵게 느껴지더라도 고민하지말고 문제에서 글로 표현된 것을 순서대로 그림으로 나타내면 됩니다.
처음 12%의 소금물 300g에서 같은 양의 소금물과 물을 빼고 더 넣었으므로 여기까지 그대로 300g,
그 다음 6%의 소금물을 더 넣어서 8% 소금물 450g이 되었으므로 6% 소금물의 양은 150g임.
∴ 75g
자, 지금까지 중학교 1학년 수준에서 시험에 나올만한 소금물의 농도 문제를 다뤄봤습니다.
그림을 그리는 이유는 어떤 상황인지 이해하고 문제에 접근하기 위해서 입니다.
처음에는 그리고 생각하는 시간이 많이 걸리겠지만 익숙해지면
그림은 머리 속에서 그려지는 이미지로도 충분합니다.
하지만 처음에 연습할 때 귀찮거나 시간이 없다는 핑계로 많이 그려보지 않으면
고난도 문제에서 당황하거나 실수를 할 수 있습니다.
소금물의 농도 문제는 고등학교 과정의 수열의 극한 단원에서도 활용문제로 다뤄지기도 합니다.
중학교 1학년 때 제대로 확실하게 이해하고 연습하면 나중에 따로 시간을 내서 공부하지 않아도 충분히 문제를 풀 수 있습니다.
다시한번 강조하지만 처음에는 많이 그려보시기 바랍니다.^^
혹시, 좀더 다양한 문제와 학습이 필요하십니까?
소금물 농도에 관한 일차방정식 활용문제를
이 포스트에 있는 설명과 같은 풀이로 해설한 워크북(Workbook)
『하루면 끝나는』일차방정식의 활용 (농도) ▶보러가기 ☜click
.
중1수학 농도 문제
반응형
중1수학 농도 문제
무게 퍼센트(%) 농도의 정의는 (A)식과 같다.
(여기서, 소금물의 양 = 소금의 양 + 물의 양)
예) 소금 20 g이 들어있는 소금물의 양이 500 g이라면, 이 소금물의 농도는?
(A)식을 소금의 양에 대해 정리하면, (B)식이 만들어진다.
예) 6% 소금물 250 g에 들어있는 소금의 양은?
—————————————————
예제1) 10% 소금물 200 g이 있다.
(가) 이 소금물에 몇 g의 물을 더 넣으면 5% 소금물이 될까?
(나) 이 소금물에서 몇 g의 물을 증발시키면 40% 소금물이 될까?
풀이) 먼저 10% 소금물 200 g에 들어있는 소금의 양을 구한다. (B)식 사용.
(가) 소금의 양은 변하지 않고, 물의 양만 변하기 때문에,
∴ 200 g의 물을 더 넣으면 5% 소금물이 된다.
(나) 소금의 양은 변하지 않고, 물의 양만 변하기 때문에,
∴ 150 g의 물을 증발시키면 40% 소금물이 된다. ————————————————— 예제2) 9% 소금물 200 g에 6% 소금물을 넣어 8% 소금물을 만들려고 한다. 6% 소금물을 몇 g 넣어야 할까? 풀이) 혼합 전/후 소금의 양은 똑같기 때문에, (B)식을 사용하여 등식을 만들어서, ∴ 6% 소금물 100 g을 넣으면 된다. ————————————————— 예제3) 6% 소금물 400 g이 있다. 이 소금물에 몇 g의 소금을 더 넣으면 20% 소금물이 될까? 풀이) 먼저 6% 소금물 400 g에 들어있는 소금의 양을 구한다. (B)식 사용. ∴ 소금 70 g을 넣으면 된다. 중1수학 농도 문제.hwp —————————————————
예제4) 4% 소금물과 7% 소금물을 섞어서 5% 소금물 600 g을 만들었다.
두 종류의 소금물을 각각 몇 g씩 섞었는지 구하시오.
풀이)
4% 소금물의 양을 x g,
7% 소금물의 양을 y g 이라 두면,
x + y = 600 … (1)
4% 소금물에 들어있는 소금의 양 = x * (4/100) = 0.04x
7% 소금물에 들어있는 소금의 양 = y * (7/100) = 0.07y
5% 소금물에 들어있는 소금의 양 = 600 * (5/100) = 30 이므로,
0.04x + 0.07y = 30 … (2)
4x + 7y = 3000 … (3)
(1)과 (3)식을 연립방정식으로 계산하면,
x + y = 600 … (1)
4x + 4y = 2400 … (4)
(3) – (4)
3y = 600
y = 200
x + 200 = 600
x = 400
답: x = 400 g, y = 200 g [키워드] 중학교 수학 기준문서
그리드형(광고전용)
So you have finished reading the 소금물 농도 문제 topic article, if you find this article useful, please share it. Thank you very much. See more: 소금물 농도 문제 pdf, 소금물 의 농도 에 대한 문제, 소금물 문제 유형, 소금물 농도 구하기, 소금물 문제 푸는법, 소금물 소금 추가, 소금물 농도 쉽게, 소금물 농도 단위

