You are looking for information, articles, knowledge about the topic nail salons open on sunday near me 줄기 세포 연구 on Google, you do not find the information you need! Here are the best content compiled and compiled by the https://toplist.pilgrimjournalist.com team, along with other related topics such as: 줄기 세포 연구 줄기세포 연구 찬반, 줄기세포 연구 현황, 줄기세포 역사, 줄기세포 치료, 줄기세포 연구 동향 2021, 줄기세포 연구 동향 2020, 배아줄기세포, 배아줄기세포 연구
Table of Contents
줄기 세포 연구
- Article author: www.kjpbt.org
- Reviews from users: 9271
Ratings
- Top rated: 4.5
- Lowest rated: 1
- Summary of article content: Articles about 줄기 세포 연구 21세기 생명공학의 화두로 등장한 인간배아줄기. 세포 연구는 그 역사가 일천함에도 불구하고 인류. 복지를 증진시키기 위한 미래의학으로 인식되고. …
- Most searched keywords: Whether you are looking for 줄기 세포 연구 21세기 생명공학의 화두로 등장한 인간배아줄기. 세포 연구는 그 역사가 일천함에도 불구하고 인류. 복지를 증진시키기 위한 미래의학으로 인식되고.
- Table of Contents:

[생명공학정책연구센터] 줄기세포치료제 동향 및 전망
- Article author: yesme.kiom.re.kr
- Reviews from users: 21493
Ratings
- Top rated: 4.9
- Lowest rated: 1
- Summary of article content: Articles about [생명공학정책연구센터] 줄기세포치료제 동향 및 전망 전분화능 줄기세포(pluripotent stem cell) 은 내배엽, 중배엽, 외배엽을 구성하는 거의 모든 종류의 세포로 분화할 수 있는 줄기세포들을 통칭한다. 전통적으로는 수정란 … …
- Most searched keywords: Whether you are looking for [생명공학정책연구센터] 줄기세포치료제 동향 및 전망 전분화능 줄기세포(pluripotent stem cell) 은 내배엽, 중배엽, 외배엽을 구성하는 거의 모든 종류의 세포로 분화할 수 있는 줄기세포들을 통칭한다. 전통적으로는 수정란 …
- Table of Contents:
![[생명공학정책연구센터] 줄기세포치료제 동향 및 전망](https://i0.wp.com/wpsites.net/wp-content/uploads/2014/06/icon-after-more-link.png)
줄기세포 연구의 발전과 치료 개발 > BRIC
- Article author: www.ibric.org
- Reviews from users: 12061
Ratings
- Top rated: 4.3
- Lowest rated: 1
- Summary of article content: Articles about 줄기세포 연구의 발전과 치료 개발 > BRIC 중상을 입거나 유전 질환 및 퇴행성 질환에 적용할 수 있는 줄기세포-기반 치료법에 대해 수많은 연구 결과가 보고되었지만, 줄기세포치료에서 증명된 … …
- Most searched keywords: Whether you are looking for 줄기세포 연구의 발전과 치료 개발 > BRIC 중상을 입거나 유전 질환 및 퇴행성 질환에 적용할 수 있는 줄기세포-기반 치료법에 대해 수많은 연구 결과가 보고되었지만, 줄기세포치료에서 증명된 … 중상을 입거나 유전 질환 및 퇴행성 질환에 적용할 수 있는 줄기세포-기반 치료법에 대해 수많은 연구 결과가 보고되었지만, 줄기세포치료에서 증명된 경우는 매우 적다. 이 리뷰에서, 우리는 현재 치료에 사용 중인 세포와 임상시험에 시도 중인 세포에 관한 연구들을 조사하였다. 또한, 임상시험에 대한 경고와 줄기세포의 임상적 사용을 뒷받침하는 결과에 대해서 과학적인 근거를 찾고, 실험적으로 접근할 방법 등을 본 리뷰에서 분석하였다.강경정,단국대학교
- Table of Contents:
 Read More
Read More
줄기세포 연구 | 차병원
- Article author: www.chamc.co.kr
- Reviews from users: 25773
Ratings
- Top rated: 3.7
- Lowest rated: 1
- Summary of article content: Articles about
줄기세포 연구 | 차병원
세계가 인정하는 차병원 줄기세포 연구성과. 2005 제대혈 줄기세포로 성인 백혈병 이식 연속 성공. 2007 줄기세포 신 배양기술인 유전자 변형 인간 배아줄기세포주 … … - Most searched keywords: Whether you are looking for
줄기세포 연구 | 차병원
세계가 인정하는 차병원 줄기세포 연구성과. 2005 제대혈 줄기세포로 성인 백혈병 이식 연속 성공. 2007 줄기세포 신 배양기술인 유전자 변형 인간 배아줄기세포주 … 차병원그룹, 차광렬, 차광열, 차광렬줄기세포상차병원그룹 홈페이지 - Table of Contents:
하단메뉴

줄기세포 – 위키백과, 우리 모두의 백과사전
- Article author: ko.wikipedia.org
- Reviews from users: 20204
Ratings
- Top rated: 3.1
- Lowest rated: 1
- Summary of article content: Articles about 줄기세포 – 위키백과, 우리 모두의 백과사전 줄기 세포(-細胞, 영어: stem cell)는 배아 또는 성체에 있는, 여러 종류의 세포로 분화할 수 있는 … 현재 세계 각국에서 경쟁적으로 줄기 세포 연구를 진행 중이다. …
- Most searched keywords: Whether you are looking for 줄기세포 – 위키백과, 우리 모두의 백과사전 줄기 세포(-細胞, 영어: stem cell)는 배아 또는 성체에 있는, 여러 종류의 세포로 분화할 수 있는 … 현재 세계 각국에서 경쟁적으로 줄기 세포 연구를 진행 중이다.
- Table of Contents:
종류[편집]
유전자 치료[편집]
속사[편집]
자가 갱신[편집]
식별[편집]
연표[편집]
줄기세포의 가치[편집]
논쟁[편집]
생명윤리법[편집]
같이 보기[편집]
참고 문헌[편집]
각주[편집]
줄기 세포 연구
- Article author: synapse.koreamed.org
- Reviews from users: 33329
Ratings
- Top rated: 3.0
- Lowest rated: 1
- Summary of article content: Articles about 줄기 세포 연구 인간배아줄기세포 이식연구는 사. 람에게 임상시험을 하기에는 너무 알려지지 않은 위험이 많. 다는 것이다. 이에 대해 대부분의 줄기세포 연구자들은 빨. 리 승인이 나기 … …
- Most searched keywords: Whether you are looking for 줄기 세포 연구 인간배아줄기세포 이식연구는 사. 람에게 임상시험을 하기에는 너무 알려지지 않은 위험이 많. 다는 것이다. 이에 대해 대부분의 줄기세포 연구자들은 빨. 리 승인이 나기 …
- Table of Contents:

글로벌 줄기세포 시장 현황 및 전망 – 대웅제약 뉴스룸
- Article author: newsroom.daewoong.co.kr
- Reviews from users: 5123
Ratings
- Top rated: 4.1
- Lowest rated: 1
- Summary of article content: Articles about 글로벌 줄기세포 시장 현황 및 전망 – 대웅제약 뉴스룸 앞으로도 탯줄유래 줄기세포 인식 증가, 줄기세포 치료제 개발을 위한 R&D 이니셔티브 증가, 줄기세포 연구관련 임상시험 승인 증가, 재생의료 관련 치료 … …
- Most searched keywords: Whether you are looking for 글로벌 줄기세포 시장 현황 및 전망 – 대웅제약 뉴스룸 앞으로도 탯줄유래 줄기세포 인식 증가, 줄기세포 치료제 개발을 위한 R&D 이니셔티브 증가, 줄기세포 연구관련 임상시험 승인 증가, 재생의료 관련 치료 …
- Table of Contents:

See more articles in the same category here: Toplist.pilgrimjournalist.com/blog.
[생명공학정책연구센터] 줄기세포치료제 동향 및 전망
가. 정의
1) 줄기세포의 정의
줄기세포는 한 개의 세포가 여러 종류의 다른 세포를 생산해 낼 수 있는 특이한 능력(다중분화능)을 가진세포들이며, 우리 몸의 손상 받은 부위의 세포들을 세로 재생할 수 있는 세포들을 통칭한다. 줄기세포(stem cell)는 기원한다는 뜻의 “stem”에서 유래하며, 일본에서는 원기세포 또는 뿌리에서 나오는 줄기라 하여 간세포 라고도 한다.
특히 줄기세포는 다른 의학적 수단이 별로 없는 퇴행성 질환이나 심한 외상으로 인한 질병을 치료할 수 있는 새로운 대안으로 부상되고 있다. 즉, 우리 몸의 장기나 조직을 줄기세포를 통해 새로 재생하는 새로운 의학적 접근인 재생의학(regenerative medicine)의 형태로 새로운 미래의학의 핵심적 화두가 되고 있다.
2) 줄기세포의 종류
줄기세포에는 분화되는 세포의 영역에 따라 인체를 구성하는 200여 가지의 세포로 모두 분화할 능력을 가진 전분화능 줄기세포(pluripotent stem cell)와 특정 종류의 세포로 분화할 수 있도록 특화된 조직-특이적 줄기세포 (tissue-specific stem cell)로 나눌 수 있다. 줄기세포를 획득하기 위한 공급원에 따라 수정란에서 출발한 배아 또는 배반포(blastocyst)에서 얻어지는 배아줄기세포(embryonic stem cell)와 발생 과정이 모두 끝난 신생아 또는 성인의 신체 각 조직에서 얻어지는 성체줄기세포(adult stem cell) 로 분류되기도 한다. 이때, 배아줄기세포는 대부분 전분화능 줄기세포에 해당하고, 성체줄기세포는 조직특이적 줄기세포에 해당한다.
성체줄기세포(adult stem cell)는 우리 몸의 다양한 장기에 있으면서, 신체가 손상되었을 때 재생작용을 하는 세포로서 골수, 탯줄을 포함해서 거의 모든 장기에 존재하는 다양한 줄기세포를 통틀어 성체줄기세포라고 한다. 성체줄기세포는 분화될 수 있는 세포의 범위가 비교적 정해져 있어 조직-특이적 줄기세포라고도 하며, 의학적으로 비교적 안전한 세포로 알려져 있어 다양한 임상시험에 사용되고 있
다.
전분화능 줄기세포(pluripotent stem cell) 은 내배엽, 중배엽, 외배엽을 구성하는 거의 모든 종류의 세포로 분화할 수 있는 줄기세포들을 통칭한다. 전통적으로는 수정란 유래의 배아조직과 배반포를 통해 얻어지는 배아줄기세포 (embryonic stem cell)가 대표적인 전분화능 줄기세포로 자리해 왔다. 그러나, 배아줄기세포는 공여자와 숙주 사이의 조직적합성 항원의 차이에 따른 면역거부반응 가능성이 있어 이러한 문제를 극복한 유전자 맞춤형 전분화능 줄기세포들이 개발되었다. 그 하나는 체세포와 난자의 핵을 치환한 후 배아에서 얻게 되는 복제배아 줄기세포이고 또 하나는 체세포를 유전자 조작에 의해 거꾸로 역분화 시켜서 배아줄기세포와 거의 동일한 상태의 전분화능 줄기세포로 거꾸로 만든 유도역분화 줄기세포(induced pluripotent stem cell; iPS)가 있다. 특히, 유도역분화 줄기세포(iPS)는 과거 배아줄기세포나 복제배아줄기세포에서와 같은 생명윤리적 갈등이 없이도, 환자 자신의 체세포로 부터 맞춤형 전분화능 줄기세포를 얻을 수 있게 되었으며, 이 기술의 성공으로 일본의 Yamanaka 교수등이 2012년도 노벨상을 수상하면서 더 잘 알려진 줄기세포이다.
나. 필요성
1) 경제적 측면 : 신성장동력으로서의 줄기세포
2013년도에 발표된 한 시장조사 보고서에 따르면 세계 줄기세포 시장 규모는 2012년 325억 달러규모에서 2016까지 두배로 증가하는 고속성장을 이어가 2018년에는 1195억달러, 즉 1조원 규모에 이를 것으로 예측되고 있다.
국내 정부에서도 이와 같은 경제적 가치를 인지하고 최근 몇 년 동안 꾸준히 관련 예산을 증대시켜왔으며, 특히 실용화와 관련된 부분의 지원을 강화하는 방향으로 보건복지부 R&D 예산이 가장 높은 증가율을 보이고 있다.
출처 : 2013 줄기세포 연구 시행계획, NIH website
2) 사회적 측면: 고령화사회에서의 수요 증가와 상용화 추세
줄기세포에 대한 수요는 의학의 발달로 고령화 사회가 빠른 속도로 진행되면서, 각종 퇴행성질환과 장기기능의 부전에서 비롯된 의학적 상황을 해결하기 위한 새로운 돌파구에 해당하는 것으로 인식되어지고 이를 상용화 하기 위한 노력들이 진행되고 있다.
2012년 국내에서 줄기세포를 기반으로 한 치료제 3개 품목 *이 세계 최초로 승인된 이래 캐나다에서도 1개 품목**이 최초로 승인되는 등, 줄기세포를 기반으로 한 치료제가 상용화를 향한 과정에 진입하였다.
* 3개 품목 : 에프씨비파미셀 ‘하티셀그램-AMI(심근경색 치료제)’, 메디포스트 ‘카티스템(연골치료제)’, 안트로젠 ‘큐피스템
(크론성 누공 치료제)’
** 1개 품목 : Prochymal (이식편대숙주반응질환 치료제)
줄기세포 연구의 발전과 치료 개발
본 자료는 Advances in stem cell research and therapeutic development. Nat Cell Biol. 2019 Jul;21(7):801-811. 의 논문을 한글로 번역, 요약한 자료입니다.
목 차
1. 서론
2. 본론
2.1. 조혈 줄기세포(Haematopoietic stem cells, HSCs)
2.1.1. 조혈 줄기세포 이식
2.1.2. 조혈 줄기세포 유전자 치료
2.2. 상피줄기세포(Epithelial stem cells)
2.3. 횡문근 줄기/ 전구세포(striated muscle stem/ progenitor cells)
2.4. 조직 특이적 줄기/ 전구세포
2.5. 재생 신경과학에서 다분화성줄기세포 유래 세포
3. 결론
1. 서론
줄기세포는 30년 이상 연구가 진행되었고 각종 치료에 광범위하게 사용되고 있다. 이로 인해, 성체줄기세포 및 다분화성 줄기세포(Pluripotent Stem Cells, PSC)의 체세포 유도체를 사용한 세포 및 유전자 치료에 긍정적인 효과를 가져올 것으로 내다보고 있다. 특히, 재생의학으로 알려진 조직 공학과 세포 및 유전자치료의 복합 치료로 인해 손상이나 질병 치료에 적용 가능성은 획기적이라 할 수 있다. 이러한 확장된 치료 의약품(Advanced Therapy Medical Products, ATMPs)들은 규제기관에서 엄격하며 과학적인 평가가 요구되고 있으며, 마케팅 허가는 제품의 품질, 안전 및 효능에 대한 엄격한 요구사항에 충족이 될 때 승인되고 있다.
지난 10년 동안 ATMPs와 관련된 임상 시험은 기하급수적으로 성장하였다. 몇몇 경우에서는 줄기세포 기반 치료는 불치병에 긍정적인 영향을 미치기도 하였다. 하지만, 많은 경우에서, 과학적 근거와 전임상 결과는 불분명했다. 임상시험에서 환자에게 해롭지 않았지만, 긍정적인 결과도 없었기에 결론적으로 유의미한 결과를 얻지 못하였다. 이를 해결하기 위하여, 줄기세포 기반 ATMPs의 복잡성과 다양성은 임상이나 이미 임상시험의 조건을 잡는 과정에서 사용된 인간 줄기세포에 대해 면밀히 검토해야할 필요가 있다 (표 1) . 이러한 임상시험을 뒷받침하는 과학적 근거와 실험 방법 및 결과에 대한 면밀한 분석은 줄기세포 기반 재생 치료의 증진을 위한 일반적인 기준을 정의하는 데 도움을 주고자 한다.
본 리뷰에서, 줄기세포의 종류와 줄기세포에서 유도된 유도체에 대한 연구에 집중하여, 줄기세포치료의 한계점과 잠재적으로 유해하고 규제되지 않은 분야에서의 지속적인 도전, 그리고 새로운 줄기세포를 이용한 치료법에 대한 논의를 하려 한다.
표1. 진행중인 줄기세포 치료법
2. 본론
2.1. 조혈 줄기세포(Haematopoietic Stem Cells, HSCs)
2.1.1. 조혈 줄기세포 이식
자가 또는 동종 조혈 줄기세포 이식(HSC transplantation, HSCT)은 방사선 또는 화학치료 후에 생긴 세포 손상을 회복시킨다. 이러한 원리를 환자의 골수를 재생에 사용하여 조혈 시스템을 재생시킨다. 이러한 방법을 적용한 첫 번째 환자는 1957년에 방사선 및 화학 치료 후에 건강한 기증자로부터 골수 세포를 정맥에 주사하여 치료를 받았다. 처음 치료를 시작한 지 20년이 지난 후, 이식편대숙주증(Graft-Versus-Host Disease, GVHD)에 대한 치료의 발전으로 백혈병의 치료뿐만 아니라 1968년에는 유전질환인 중증 복합 면역 결핍(Severe Combined, SCID)을 앓고 있던 5개월 남아에 이를 적용하여 골수 이식이 성공적으로 이루어 졌다. 지난 50년 동안, 조혈 줄기세포 이식은 40만 명이 넘게 수행되었고, 조혈시스템의 중증 유전성 및 후천성 질환과 혈액학적 악성 종양에 대한 치료 방법으로 자리 잡았다. 조혈 줄기세포의 재생 능력에 더하여, 신생 질환을 치료하기 위한 동종 이식은 graft-versus-malignancy과 graft-versus-infection 반응에 활용 가능하고, 어떤 경우에는 손상된 조혈 기능을 보완하기 위해 세포나 유전자치료에 이용된다. 관련 절차의 개선으로 화학 요법의 독성, 감염 및 이식편대숙주증의 위험이 감소하였지만, 동종 조혈 줄기세포이식은 여전히 임상 의학의 미래 발전에 대한 한계점을 넘어서기 위한 도전 중이다.
2.1.2. 조혈 줄기세포 유전자 치료
지난 20년 동안 체외 조혈 줄기세포 유전자 치료(HSC-GT)는 1차적인 면역결핍, 혈색소 이상 빈혈(haemoglobinopathies), 신경 관련 대사장애를 포함하는 단발성 질환에 대한 효과적인 치료로 발전해왔다. 자가이식법이기 때문에, HSC-GT는 호환되는 공여자를 필요로 하지 않아 HSCT 보다 GVDH 또는 면역 거부의 위험이 없다는 장점을 가진다. 조혈 줄기세포 유전자 치료의 첫 번째 의약품인 Strimvelis는 Adenosine DeaminAse (ADA) 결핍으로 인한 중증 복합 면역 결핍 치료제로 2016년 EU에서 승인되었다. clinical trials.gov의 조사에 따르면, 2020년까지 EU와 미국에 예상되는 HSC-GT 제품의 등록 개수는 최소 다섯 개 이상이며, 다양한 유전질환에 대한 임상연구는 20개 이상 진행되고 있다고 보고되었다. 이러한 접근 방법들의 성공 여부는 조혈 줄기세포 이식의 광범위한 임상 경험과 치료를 위한 유전자를 전달할 수 있는 바이러스 벡터를 사용하여, 영구적으로 조혈 줄기세포를 치료하고 환자 내에서 존재할 수 있도록 생체 외에서 조혈 줄기세포를 조작하는 능력이 얼마나 발전하는지에 의해 결정된다.
조혈 줄기세포 유전자치료를 위해, 자가 이식된 조혈 줄기세포는 drug-induced mobilization 후에 환자의 골수나 말초 혈액에서 채취되고, CD34+ 세포 분리 정제를 통해 농축 시켜 바이러스 벡터로 인해 형질 전환된다 (그림 1, 가). 형질 전환된 세포는 유전자 조작이 일어난 후 또는 동결보존과정 후에 재 주입된다. 자가 조혈 줄기세포 기반 유전자치료(HSC-based GT treatment)에 관여하는 인간 생체 물질의 수집, 전달, 처리, 샘플링 및 배송은 엄격한 품질 표준 및 규정을 준수해야 하는 복잡한 과정이다. 따라서, 스폰서나 자격증 보유자, GMP (Good Manufacturing Practice) 생산 시설 및 조혈 줄기세포의 수집, 전화학 치료 및 조혈 줄기세포 유전자 치료의 관리와 관련된 이식 센터 사이의 엄격한 협력이 필요하다. 환자는 일반적으로 준비 단계의 conditioning 요법 및 면역 억제제의 투여량(또는 횟수)을 감소시킴으로써 조절될 수 있는 내인성 조혈 줄기세포를 없애기 위한 화학치료를 받는다. ADA-중증 복합 면역 결핍을 치료하기 위해서, 조혈 줄기세포-유전자 치료에 대해 강도가 낮은 치료의 사용을 처음으로 도입한 후, 다른 치료로 확장하여 conditioning 요법을 치료 목표 및 질환에 조정하여 사용하였다. 2000년 이래로 27명의 ADA-중증 복합 면역 결핍 환자들은 ADA를 인코딩하는 γ-retroviral vector (Strimvelis의 주입을 받은 5 명의 환자 포함)로 유전자 도입된 조혈 줄기세포로 치료를 받았으며 모두 성공적으로 치료되었다. 대부분의 환자에, 조혈 줄기세포 유전자치료는 면역 및 대사 기능을 복원 할 수 있는 단일 치료로 사용될 수 있음이 증명되었다.
ADA-중증 복합 면역 결핍의 경우를 제외하고, γ-retroviral vector를 기반으로 하는 조혈 줄기세포 유전자치료의 가장 큰 한계는 강한 바이러스의 증진으로 세포의 종양 유전자(oncogene)의 활성에 의한 삽입 돌연변이 때문에 혈액학적 악성종양이 발달하는 것이었다. 이러한 결점은 자가-불활성화 lentiviral vectors에 대한 연구의 발달을 촉진했다. 전임상 연구에 따르면 lentiviral vector는 더 안전한 통합 프로파일을 가지며 가장 원시적 인 조혈 줄기세포로 효과적인 유전자 도입을 허용한다. 특히 9가지의 다른 유전 질환을 앓는 150명 이상의 환자들이 지금까지 lentiviral 도입된 조혈 줄기세포로 치료되었다. 이를 근거로 유전자 도입된 조혈 줄기세포는 매우 안전하게 치료가능한 유전자를 발현하여 임상에서 유용하다는 평가 받았다. 대부분의 조혈 줄기세포는 현재 lentiviral vector로 유전자 도입될 수 있으며, 80-90%의 효율을 가지고 생체 내 골수의 안정적인 착생을 유도한다. 탈수초화 및 신경퇴행성 질환인 부신백질이영양증(X-linked adrenoleukodystro-phy)에 대한 임상 시험에서 17명의 환자 중 15명은 유전자 치료를 받은 후 2년 이상 신경학적 기능이 안정적임을 보여주었다. 중추 및 말초신경계에서 일어날 수 있는 치명적인 리소좀의 질환인 이염백질이영양증(Metachromatic leukodystrophy, MLD)의 초기 발병에 대한 조혈 줄기세포 유전자치료는 중추신경계와 순환시스템에서 조혈 줄기세포를 치료하는 효소의 생성이 활성화되고, 조혈 줄기세포수가 증가하는 결과로 이어졌다. 또한, 이염백질이영양증을 치료한 9명 환자 중 8명이 질병의 예방되거나 질병의 진행이 멈추었다. 이 결과는 이염백질이영양증전 증상을 가지고 있는 초기 단계 혹은 중증의 환자에게 치료 효과가 있다는 것을 보여주었다.
면역 결핍에 관한 첫 번째 연구에서 관찰된 유전 독성 이상 반응 후, self-inactivating retro-viral 또는 lentiviral vector에 기초한 안전성을 개선하는 접근법이 성공적으로 구현되었다. 면역 세포 및 혈소판의 중증 질환인 Wiskott-Aldrich Syndrome (WAS) 의 경우, 조혈 줄기세포는 자체 프로모터 하에 발현된 WAS cDNA를 갖는 lentiviral vector로 형질을 도입하였다.
임상 시험의 중간 결과에서는 감염에 대한 효과적인 예방, 자가 면역과 출혈에 관한 면역학적 개선 등의 긍정적인 효과를 보여 주었다. 특히, 이 질환은 적혈구에 특이적이며, 초기에 조절 가능하고 도입된 유전자를 지속적으로 발현시키는 것이 어려웠기 때문에 치료를 성공으로 이끄는데 어려움이 있었다. 임상 1,2상에서 조혈 줄기세포 유전자치료는 β-thalassemia 환자에서 장기간의 적혈구 수혈의 필요성을 줄이거나 없앨 수 있다는 결과를 도출했다. 두 연구는 HSC 투여 경로(여과 기관에 갇히는 것을 피하기 위해 정맥 주사의 골수 주입, conditioning 요법을 통해 다른 연령의 환자에게 진행되었다. 항-sickling β-globin 변이체를 인코딩하는 lentiviral vector로 형질 도입된 조혈 줄기세포는 겸상 적혈구 빈혈(sickle cell disease)환자에서 성공적인 결과를 나타냈다. 또한, 형질 도입된 조혈 줄기세포를 이용한 고무적인 결과는 ADA-중증 복합 면역 결핍, 만성 육아 종증(chronic granulomatous disease) 및 판코니 빈혈(Fanconi anemia)에 대한 임상 시험에서 효과가 있었다는 것이다.
Site-specific endonuclease를 사용한 조혈 줄기세포에서 Genome editing은 일차 면역 결핍과 haemoglobinopathies에 대한 임상적용으로 진행하고 있다. 이러한 방법은 RAG1, RAG2 또는 CD40-리간드 면역 결핍과 같은 유전자 발현의 엄격한 조절이 요구되는 질환들에 이용 될 수 있다. 그 예로, 적혈구 질환에 대한 임상 시험에는 태아 헤모글로빈 양을 증가시키기 위해 글로빈 유전자 발현을 조절하는 genomic loci를 방해하는 유전자 도입된 자가 조혈 줄기세포를 포함하고 있다.
유전적으로 치료된 조혈 줄기세포를 주입한 환자는 실제로 주입된 조혈 줄기세포와 특정 유전자 부위에서 치료 벡터에 의해 유전자 도입된 세포들은 표식 됨으로써, 인간의 hematopoiesis를 연구하기 위한 고유한 모델이 된다. 삽입 부위 분석은 다른 lineage를 걸쳐서 재조합 조혈 세포 클론을 효율적으로 추적하고, 장기간 추적관찰 동안 그들의 행동반경을 모니터링할 수 있다. 이 분석은 lentivirus-형질 도입된 조혈 줄기세포의 다분화능(multilineage-potential)과 지속적인 장기 조혈 줄기세포 표식을 입증하였고, 조혈 줄기세포 유전자치료(HSC-GT) 후에 조혈에 관여하는 조혈 줄기세포 수에 대한 정보를 제공했다. 또한, 이 분석에 의해 조혈 줄기세포는 이식 후 초기 단계와 후기 단계에 다르게 기여하고, lineage 사이의 계층적 관계를 식별하는 별개의 조혈줄기/ 전구세포(HSPC)의 하위 유형이 있음을 보여주었다. 이로써 수년간 축적된 상당한 수의 연구 결과와 gene-editing 방법 등의 발전은 조혈 줄기세포 유전자 치료가 보다 더 안전하고 효율적인 사용을 할 수 있는 근거로 활용 될 수 있을 것이다.
2.2. 상피줄기세포(Epithelial stem cells)
1975년, 처음으로 인간 epidermal keratinocyte 배양 연구가 시작되었다. 그 이후 10년이 채 지나지 않아서 신체의 95% 이상이 화상으로 고통을 받는 두 아이에게 자가 배양한 keratinocyte의 이식을 치료에 사용하여 효과를 보았다. 현재, 전 세계적으로 keratinocyte 배양이 3도 화상 환자를 대상으로 치료에 사용할 수 있도록 기술이 진보하고 있다. Keratinocyte를 줄기세포라고 생각하지 않을 수 있지만, 1975년에 처음으로 배양해낸 keratinocyte는 현재 우리가 알고 있는 줄기세포의 의미와 일치한다. 일차 표피 배양의 클론 분석을 포함하는 후속작업에서, 3가지 종류의 클론성 keratinocyte (holoclones, meroclones 및 paraclones)가 식별되었다. Holoclone을 형성하는 keratinocyte는 모든 줄기세포의 특징을 가지고, 일시적으로 증폭하는 전구세포(transient-amplifying progenitor)의 특성을 가지는 meroclone과 paraclone을 생성한다. Holoclone을 형성하는 세포는 표피이식에서 필수적이며, 장기적인 표피 재생을 위해 필요하다.
이식 후 착생의 실패는 적절하지 않은 배양 조건으로 인해 holoclone 형성 세포의 손실에 의해 야기된다. 각막 상피 줄기세포를 포함하는 각막 가장자리 세포(ocular limbal cells)의 배양에도 유사한 접근법이 사용된다. 시력은 각막이 깨끗한지, 기질에 혈관이 없는지, 상피의 상태에 따라 영향을 미친다. 각막 상피의 복구 및 재생은 각막 가장자리와 각막과 안구 결막 사이의 좁은 공간에 존재하는 줄기세포에 의해 매개된다. 각막의 다양한 화학화상으로 각막 가장자리는 손상을 입을 수 있고, 각막 가장자리 줄기세포의 결핍(LSCD)을 일으킬 수 있다. 이러한 상태는 신생 혈관 형성, 만성 염증, 기질 흉터, 각막 불투명의 특징을 나타나며, 안구 결막 세포의 침입으로 시력이 전반적으로 감소한다.
결막 과증식을 예방하기 위한 방안으로, 손상을 받지 않은 눈으로부터 한쪽 LSCD에 각막 limbal 조직을 이식하는 것이다. Limbal 배양은 holoclone으로써 관찰되는 줄기세포를 포함하고, 각막 상피의 완전한 기능 재생을 가능하게 하는 자가 limbal 배양의 치료 방법으로 개발되어왔다. 이 치료법은 한쪽 LSCD 환자와 심각한 양측 각막 손상 환자에서 시력을 회복시켰다. 눈의 건강한 lim-bus는 1-2 mm2로 두 눈의 각막 상피를 회복시킬 수 있는 limbal 배양에 충분하다. keratinocyte는 콜로니 크기, 상피세포 성장률, limbal 클론원성 세포의 수는 임상적으로 예측할 수 없기 때문에 일시적인 전구세포로 추측하며, 특히 조직재생 동안 상피 줄기세포에 인접한 전구세포는 줄기세포의 기능을 적절하게 촉진시킨다는 것을 시사한다.
편평 상피 세포에서 중요한 전사조절인자인 p63의 발견은 limbal 배양에서 줄기세포의 양을 측정하는 기준을 잡는 데 도움이 되었다. 특히, ΔNp63α isoform은 상피 줄기세포의 증식 능력을 나타내며, holoclone에서 meroclone으로 clonal transition 동안 ΔNp63α isoform의 발현은 감소되고, parapclone에서 발현은 없어진다. 따라서, holoclone에서 ΔNp63α양을 측정하는 것은 limbal 배양에서 줄기세포의 양을 예상할 수 있는 척도로 사용될 수 있다. 치료에서 limbal 배양의 성공은 p63bright holoclones의 정의된 비율과 관련이 있다. 현재로서는, 치료의 성공이나 장기적인 각막 안정화(20년 간 follow-up)에서 다른 limbal 줄기세포 마커들에 대해서는 관련성이 밝혀지지 않았다. 혈관이 존재하지 않는 각막 상피의 재생으로 증상(화상, 통증 및 광선공포증)은 완화시키지만, 기질의 흉터가 있는 환자의 완전한 시력 회복은 각막이식을 필요로 한다. 이것은 완전히 기능까지 회복된 각막 상피가 없으면 성공하기 어렵다는 것을 나타낸다.
2015년에 자가 limbal 배양은 유럽 의학기구(European Medicine Agency, Holoclar)로부터 판매 허가를 받은 최초의 줄기세포 기반인 ATMP였다. 전 세계의 많은 다른 기관들은 종종 다른 배양 시스템으로 안구 화상을 치료하기 위해 limbal 배양을 사용했다. 그 당시엔 상피 클론 유형에 따른 임상 결과의 상관관계는 연구되지 않았다. Keratinocyte 배양을 이용한 피부와 각막 화상에서 상피 재생은 인간 편평 상피를 유지하는 수명이 긴 줄기세포로써, holoclone을 형성하는 세포의 식별에 대한 간접적인 증거만을 제공하였다. 상피 배양을 임상에 적용한 지 30년 후에 ex vivo에서 세포 및 유전자 통합 치료로 줄기세포와 세포 식별에 관한 증거가 공식적으로 입증되고 있다. 수포성 표피 박리증은 드물게 일어나는 유전질환으로, 중증도 및 유병율이 다른 네 가지 유형으로 단순형수포성표피박리증(Epidermolysis Bullosa Simplex, EBS), 연접부수포성표피박리증 (Junctional Epidermolysis Bullosa, JEB), 이영양성수포성표피박리증(Dystrophic Epidermolysis Bullosa, DEB), 킨들러증후군 (Kindler syndrome) 등으로 분류 할 수 있다. JEB는 laminin 332 (laminin 5)와 같이 인코딩되는 3개의 유전자(LAMA3, LAMB3, LAMC2)와 collagen XVII 및 α6β4 integrin을 인코딩하는 유전자의 돌연변이로부터 발병한다. 초기발달에서, laminin 332의 결핍은 굉장히 치명적이다. 일반적인 JEB에서 laminin 332는 감소되고, 이때 hemidesmosome은 발달되지 않거나 결여된다. 이러한 결과로, 경미한 외상에서 기저막층 내부에 존재하는 점막 또는 피부의 물집과 침식을 생성한다. 광범위한 만성 피부염은 환자의 삶의 질을 떨어뜨리고, 감염과 상처를 반복한다. 더욱이, 일반화된 열성 DEB와 JEB은 질환이 진행됨에 따라서 공격적인 편평세포암종이 발병하기 쉽다. 더욱 안타까운 점은 JEB에 대한 완전한 치료법은 현재 존재하지 않는다는 것이다.
자가 줄기세포 함유 표피 배양 세포는 LAMB3- 결핍 JEB치료를 위해 처음으로 이식하였다. 세포들은 Moloney leukaemia virus의 long-terminal반복의 조절 하에서 full-length LAMB3 cDNA를 발현하는 γ-retroviral vector (γRV)를 유전적으로 변형하여 사용하였다. 최근에, 이러한 체외 세포와 유전자치료를 융합하여 예후가 좋지 않은 질병인, 심각한 형태의 JEB를 앓고 있는 7세 아동 환자에 적용하여 전체적인 표피 세포의 재생을 이뤄냈다. 마지막 추적 관찰에서, 환자의 형질전환된 표피는 정상적인 수준의 laminin 332를 발현하였고, hemidesmosome의 두께 및 형태는 정상적이었으며 온전한 기저막을 가지고 있었다. 특히, 형질전환된 표피에서의 clonal selection의 부재는 시험 관내 및 생체 내 모두에서 확인되었다. JEB를 앓는 3명의 환자들은 γRV로 형질 도입된 표피세포와 4×108 개의 형질전환된 clonogenjc keratinocyte를 투여하여 3.5-13년 동안 추적조사를 한 결과, 종양 발생이나 다른 부작용이 나타나지 않았다. γRV와 유사한 γRV 벡터를 열성 DEB에 대한 임상 1상 및 2상에 사용되었다. HSC와 마찬가지로, 안전한 바이러스 벡터의 개발은 표피세포의 형질전환에 매우 유용하다.
HSC 와 유사하게 클론 유전 표식으로써, retrovirus 융합을 사용한 클론 추적 실험은 포유류 표피가 전구세포에 의해 분화되어 유지되는지에 환자의 형질전환된 표피는 세 가지의 가설의 입증을 통해 그 궁금증을 해결해 주었다. 첫째, meroclone 과 paraclone이 아닌 holoclone 형성세포는 시험관 또는 생체 내에서 광범위하게 자가 재생이 가능하다. 둘째, meroclone 과 para-clone은 이식 후 몇 달 이내에 점진적으로 상실되는 일시적인 전구세포이다. 셋째, 인간 표피는 수명이 짧은 전구세포를 생성하는 제한된 수의 holoclones에 의해 유지된다. 이 전구세포들은 계속적으로 분화된 세포를 보충하고, 상처 치유에 짧은 시간이 걸린다. 이런 점에서, 모든 holoclone 형성 세포가 동일한 지 또는 이들 사이에 계층이 존재하는지를 확인하는 것은 미래에 풀어야할 과제이다.
이와 관계되어, 배양된 상피세포 이식에서 치료의 가능성을 높이기 위해 가장 중요한 것은 holoclone으로 식별된 줄기세포의 수를 적절하게 유지하는 것이다. 따라서, 이런 기준은 새로 개발된 keratinocyte 배양 시스템이 임상시험 진행 전에 신중하게 평가되어야 한다. 상피 줄기세포에 대한 수십 년의 연구에서 얻은 지식과 경험을 통한 다양한 형태의 수포성 표피 박리증 치료를 주도로 임상 시험에 적용하고 있다.
2.3. 횡문근 줄기/ 전구세포(striated muscle stem/ progenitor cells)
골격 및 심장 근육은 구조적 및 기능적 유사성에도 불구하고, 배아 유래 및 재생 능력은 서로 상이하다. 포유류에서 골격근은 급성 및 만성 손상 후에 확실하게 재생되는 반면, 심장 근육은 출생 후 생애 첫 날 이후에는 재생되지 않는다. 따라서, 골격근에는 줄기세포가 존재하지만 심장 근육에는 없다는 것을 알 수 있다. 하지만, 심장에 관해서 여전히 알려진 바가 많이 없고, 골격 및 심장근육 질환에서 어떠한 줄기세포 치료도 효과적인 치료를 하지 못하였다.
골격근에 존재하는 줄기세포는 위성세포(satellite cells)이며, 1961년 Mauro에 의해 처음 보고되었다. 위성세포는 근육막과 기저층 사이에 위치하고 쌍을 이루는 유전자 Pax7를 발현한다. 반대로, 초기 Pax3는 주로 태아의 위성세포와 특정 성인 근육에서 발현된다. 위성세포는 출생 후 성 성숙과 함께 근육 성장에 기여하고 휴지기로 들어간다. 손상을 입으면, 다시 활성되고, 새로운 줄기/ 전구세포뿐만 아니라 근섬유 재생 또는 교체를 위해 근육세포에 도움을 준다. 현재, 위성세포는 재생 및 노화에서의 기능에 대한 연구대상이며 위성세포의 기원 및 출생 후 성장에서 역할에 대한 연구는 진행이 더 필요한 상황이다.
연속적인 이식 실험으로 마우스 세포에서 줄기세포 분화능을 가지게 되었지만, 인간 세포는 반복적인 퇴행-재생으로 심각한 형태의 근이영양증에 의해 줄기세포를 소진함으로써 self-renewal 능력이 제한되었다. 1990년대에, 위성 세포를 마우스 근육으로 성공적으로 이식 한 후, 뒤센 근이영양증(Duchenne Muscular Dystrophy, DMD)에서 세포 이식을 위한 몇 가지 임상 시험이 수행되었다. 시험 관 내에서 확장 후, 공여자 핵 및 dystrophin이 개체에서 검출 되었음에도 불구하고, 위성 세포-유래 전구세포는 소수의 환자 근육에 직접 주입되었지만, 독성과 효능은 없었다. 이는 이식된 세포의 사멸로 인한 생착 실패와 주사 부위에서의 적은 세포 이동은 큰 근육의 근육 내 이식을 매우 어렵게 만들기 때문으로 그 이유를 설명 할 수 있다. 최근에, 인두근육으로의 근내 주사는 삼키는 것에 대한 어려움을 겪는 눈인두 근이영양증에 의해 영향을 받는 사람들에게 일부 임상 치료에서 도움이 되었다. 위성세포-유래 전구세포를 이용한 다른 임상 시험은 요실금같은 괄약근의 국소 부위 손상에 대해 진행되고 있다. 임상시험은 일부 도움이 되지만, 환자 집단의 het-erogeneity 및 이러한 병변의 다양한 심각성을 고려할 때 결과 측정 및 연구 설계는 쉽지 않다.
골격근에는 위성세포 외에도 많은 다른 세포 유형이 포함되어 있으며, 일부는 초창기에 기본 조직(fibroblasts, vessel pericytes, smooth muscle, endothelium, Schwann cell, tenocyte)에 의해 식별되고 일부는 최근에 Pw1 (PW1+/ Pax7- 간질 세포, PICs) 또는 PDGFRα (섬유-지방 생성 전구세포)와 같은 특정 마커의 발현에 의해 식별된다. 이들 세포는 모두 줄기세포가 아니지만, 근성장과 재생에 참여하고, mesoangioblasts는 TNAP (tissue non-specific alkaline phos-phatase)를 발현하는 muscle perivascular cells의 시험관 내 대응물이다. TNAP-Cre 마우스의 사용을 통해, mesoangioblasts는 근성장과 재생에 제한적이라는 것을 보여주었다. 인간 mesoangioblasts는 임상시험에서 DMD환자(염증이 있는 혈관 벽을 가로지름)의 동맥 내로 이식되었고, 사용에는 안전하다고 확인되었지만 매우 열악한 착생 때문에 치료 효율은 낮았다. 이에 따라, 낮은 생존율과 열악한 착생 및 느린 이동은 명확한 임상 효능에 도달하기 전에 해결해야 할 과제이다.
심장 줄기세포의 경우, 약 20년간 다른 세포 유형과 심장 병리(주로 심근경색)와 같은 전임상 모델 및 임상시험에서 많은 수의 보고가 되어왔다. 2001년에 보고된 심근경색에 골수세포를 이식한 후 심장의 재생이 효과적으로 나타났다는 결과가 보고 되었으나 재현연구에서 그 효과는 나타나지 않았다. 이것은 심근세포의 생존 및 angiogenesis를 촉진시키는 paracrine factors의 분비 때문에 발생되는 결과로 많은 사람들이 생각하였다. 이와 같은 효과는 cKit, Islet-1 및 Sca-1과 같은 마커를 기반으로 심장 자체에서 분리된 다른 전구 세포를 포함하여, 심근경색이 일어난 심장에 이식된 대부분의 세포 유형에 적용되는 것으로 생각할 수 있다. 또 다른 연구인 이중 표지된 심장 및 비 심장 세포의 관계에서 심장 세포가 발달 중에 비 심장 세포를 쉽게 생성한다는 것을 증명하였지만, 부상을 입었을 때 성인에게서 발생하지 않는다는 것을 알 수 있었다.
배아 줄기세포(ESC) 또는 리프로그래밍된 줄기세포로부터 유래한 심장 전구세포는 현재까지 동물 모델에서만 시험되었다; 하지만, 이러한 줄기세포들이 심장세포로 분화되는 것은 보다 제어되어 있고, 심근의 재생에 대해서 이러한 줄기세포들의 기여는 훨씬 중요하다. 영장류 심장에서 인간 ESC-유래 심근세포를 사용하여 심근의 광범위한 재건이 달성되었지만, 환자에게 적용하기 위해서는 시험관 내 세포 확장과 평생 면역을 억제하는 것과 같은 여전히 상당한 노력이 필요하다. 새로 생성된 심근 세포의 크기는 배아의 크기(성인의 3분의 1)이며, 이로 인해 부정맥이 쉽게 발생할 수 있다. 전임상 실험 까지만 확인된 다른 방법으로는 세포 이식을 하지 않고, 줄기세포를 사용한 것과는 다른 전략으로 재생을 촉진하는 것이다. 그 방법들 중 하나는 내제성 심장 전구세포를 in situ에서 활성화 시키거나 심장 마스터 유전자의 전달을 통해 섬유아세포를 cardiomyocyte로 trans-differentiation 시키는 것이다. 또 다른 방법으로는, 외부 심장 패치를 적용하거나 부분적인 세포 리프로그래밍을 통해 심근 세포 및 혈관 세포로 분화할 수 있는 미성숙 세포로 만드는 것이다. 결론적으로, 많은 실험 및 임상시험에도 불구하고, 횡문근 줄기/ 전구세포에 대해 비교적 잘 알려져 있지 않으며, 미래의 임상시험을 통해 이들 세포와 재생 능력에 대한 많은 정보를 제공 받을 것으로 기대하고 있다.
2.4. 조직 특이적 줄기/ 전구세포
“중간엽 기질 줄기세포(mesenchymal stem cell/stromal cell)” 라는 용어는 광범위하게 사용되며, 철저한 기준에 기초한 줄기세포가 아닌 모든 부착성 섬유아세포의 집단을 의미한다. 이 용어는 Friedenstein과 Owen에 의해 연골, 뼈, 조혈을 도와주는 기질과 골수 지방세포(현재는 skel-etal stem cell, SSCs로 알려져 있음)를 재생할 수 있는 non-hematopoietic bone marrow stromal cells (BMSCs)인 클론성 집단으로 처음 설명되었다. 이들의 다분화성으로 인해, 다른 lineage에 있는 다른 중배엽의 결합조직(근육, 힘줄, 인대, 지방조직 등)으로 분화할 수 있다는 것을 예상했다. 따라서 이 세포를 중간엽 줄기세포(mesenchymal stem cell)로 다시 명명하였다. 그러나, 이 용어는 두 가지 이유로 생물학적으로 잘못된 용어라 볼 수 있다. 첫 번째는 중간엽은 결합조직, 혈액 및 혈관을 만들 수 있는 배아 결합 조직이지만, postnatal stem cell에는 이러한 능력이 없다는 점이다 (참조: https://embryo.asu.edu/pages/mesenchyme ). 두 번째로, 다른 결합 조직은 neural crest와 중배엽 세포의 다른 기준으로부터 유래되지만 (그림1, 나) , 일반적으로 “중간엽 줄기세포”는 배아발달 동안 또는 postnatal organism에서 존재하지 않는 것이다.
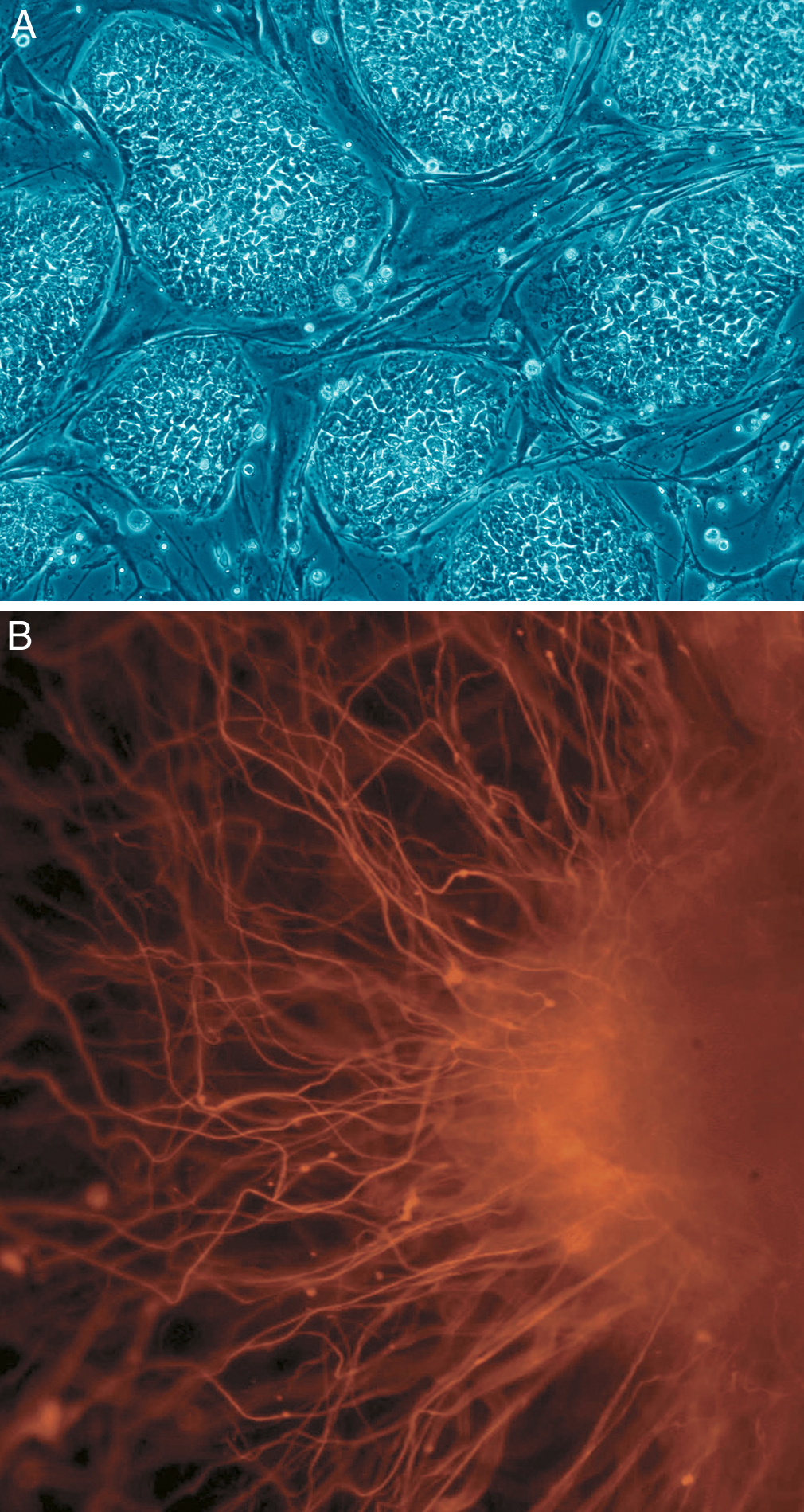
그림1. 골수에서 얻어낸 줄기세포.
(가) 조혈 줄기/ 전구세포(HSPC)와 유전자치료의 도식적 개요. 자가이식 조혈 줄기세포는 drug-induced mobilization 후에 환자의 말초혈액(1-1)이나 골수(1-2)에서 채취되고, CD34+ 세포 분리 정제 (2) 후에 체외에서 짧은 기간 배양되고, 바이러스 벡터(gamma-retrovirus 또는 lenticiral vector)와 함께 주입된다 (3). 제작과정의 끝에 세포들은 동결 보존되거나 재주입을 위해 즉시 준비된다, 유도된 조혈 줄기/ 전구 세포(의약품)의 재주입 전에, 환자는 다양한 농도에서 화학치료를 한번 또는 그 이상 받게 된다 (4). 자가이식 조혈 줄기/ 전구세포는 일반적으로 환자의 화학치료가 끝난 지 1-2일 후에 정맥주사로 재주입된다 (5). 환자들은 치료결과를 몇 년간 추적된다 (6). 삽입 부위 분석은 조혈 줄기/ 전구 세포의 fate dynamic과 안전 측면의 정보를 제공하는 데 유용하다.
(나) 골격줄기세포(Skeletal Stem Cells, SSCs)은 골수기질세포(Bone Marrow Stromal Cells, BMSCs)의 부분으로 골수 sinusoid의 가운데에 혈관주위 세포들에서 찾을 수 있다. 체내 SSCs/ BMSCs의 이식은 혈관 주위 세포를 재결성하는 능력을 증명하고(self-renewal의 증거), 뼈와 조혈 줄기세포와 골수 지방세포를 지지하는 기질(stroma)로 분화한다. 시험관(in vitro)에서 pellet culture 시에는 연골세포로 분화할 수 있다.
대부분의 경우, 다른 조직으로부터 “중간엽 줄기세포”의 불분명한 식별과 그들의 기능의 이해에 부족함에도 불구하고, 임상에 사용하기 위하여 지속적인 노력을 하고 있다. 최근 몇 년 간, 규제되지 않은 절차에서 특성화 되지 않은 세포를 사용하는 것에 대해 의문의 여지가 있었고, 때때로 환자에게 유해한 결과를 만들기도 했다. 재생 의학에서는 현재 “medical signaling cells”로 명칭이 변경된 “중간 줄기세포”는 그들의 추정적 주변분비(paracrine), 면역 조절 및 면역 억제 효과에 기초하여 많은 질병 및 장애를 치료하는 데 사용되고 있다. 지금까지 900건이 넘는 임상 시험이 합리적인 근거 없이 공식적으로 등록되었다 (참조: https://clinicaltrials.gov/ ). 해당 연구에 따르면 세포들은 전신 주입 또는 직접 주사하면 빠르게 사라진다고 한다. 또한, 이런 세포의 사용과 작용 메커니즘에 대한 이론적 근거는 명확하지 않다. ‘줄기세포’ 치료로써 이러한 치료요법을 명칭하는 것은 주변분비(paracrine)와 면역조절효과가 줄기세포 subset 으로부터 발생한다는 증거가 없기 때문에 많은 오해를 일으킨다. 줄기세포 치료로 인해 예상되는 효과는 세포 전체의 집단을 기반으로 하기 때문에, 모두 줄기세포로 인한 것은 아니다. “중간엽 줄기세포” 또는 “medical signaling cells”를 사용한 일부 임상시험에서 이들 세포가 안전하다고 하지만, 대부분의 임상에 관한 결과들은 이용할 수 없으며, 소수의 발표된 연구에서 좋은 결과를 얻지 못했다. 예를 들어, “중간엽 줄기세포”에서 유래한 ‘심근 세포’를 이용한 최근의 연구는 진행된 허혈성 심부전의 개선을 보여주지 못했다. 마찬가지로, 지방 유래 “중간엽 줄기세포”를 사용한 연구는 더 나은 임상시험 결과가 보고되었지만, 항문 주위 누공의 폐쇄 및 치유를 입증하지는 못했다.
임상시험뿐만 아니라 많은 사람들이 규제 기관의 승인 없이 골수 또는 지방흡입물을 사용하여 검증되지 않은 치료에 비용을 지불하고 있다. 이러한 치료로 인해 황반변성 치료 환자에서 급성 시력 손실과 같은 위험한 부작용이 보고되었다. 이러한 사례는 “중간엽 줄기세포”가 무엇인지, 적절하고 효과적인 방식으로 치료에 사용될 수 있는 방법은 무엇인지에 대해 일반의 뿐만 아니라 생의학 연구자들에게 더 많은 교육이 필요하다는 것을 강조하였다. 중요한 것은 임상용으로 부적합한 재료에 대한 명확한 지침을 만들어야 한다는 것이다.
하지만, 진짜 조직 특이적 줄기/ 전구세포(TS/ PCs)는 “중간엽 줄기세포”를 포함하며, 몇몇 조직에서 존재한다고 보고되었다. 그래서 우리는 이러한 집단을 분류하고 정의하기 위해, 세포들은 정확한 분석에 의해서 세포의 유래 조직과 분화 능력에 따라 명명 되어야 한다고 주장하려 한다. 뼈에서 골격 줄기세포(skeletal stem cells)는 연골, 뼈, 기질 및 골수 지방세포를 생성하는 능력에 기초하여 식별된다 (그림 1b). 지방조직에서는 지방세포를 형성하는 능력에 기초하여 TS/ PC를 ad-ipose stem/ progenitor cells이라고 불러야 하는 것이 옳다고 생각한다. Fibroblast를 포함하는 많은 조직들은 유사한 세포 표면 마커들을 가지고 있지만, 이 마커들은 특이적이지 않으며 줄기세포 집단을 식별하는 데 사용될 수 없다.
다양한 인간 조직에서, CD146+ 세포(CD45와 CD31에 대해서는 음성)는 많은 유형의 줄기세포에서 공통적인 특징인 클론원성(clonogenic)이다. 세포 표면 마커들은 거의 동일하지만, transcriptome 분석과 분화 분석에서 OD146+ 세포의 고유한 분화능력은 현저한 차이를 나타냈다. 또한, CD146+ 세포는 실제로 초기 혈관 주위를 감싸서 안정화시키는 세포인 pericyte로 식별되었다. 마우스 골수에 존재하는 LEPR 양성 세포는 골격 줄기세포의 pericyte에서 특성을 나타낸다. 이러한 흥미로운 발견은 다른 조직에서 prticyte의 형성은 일반적인 발달과정 이며, 그로 인해 성장하는 혈관은 lineage commitment가 일어나는 각기 다른 단계에서 국소세포들을 포획하게 된다는 것이다. 이 세포들은 손상이나 조직의 재형성을 위해 활성화가 될 때까지 혈관 표면에서 휴지기로 유지하다가 기원 조직을 보충해 주지만, lineage를 벗어난 기능을 하는 세포유형으로 분화될 수는 없다. 하지만, pericytic 마커인 Tbx18을 사용한 연구는 다른 조직에서 상주 전구세포인 pericyte를 식별하지는 못했다. 그렇기 때문에 이 가설을 증명하기 위해서는 추가적인 연구가 더 필요하다고 생각한다.
드물지만 기능적 조직을 재생하기 위한 TS/ PC의 몇 가지 성공적인 임상 사례가 존재한다. Quarto, Cancedda와 동료 연구자들은 ex vivo에서 배양한 자가 SSCs/ BMSCs로 거대 골 결손 환자 3명에게 치료한 사례가 있으며, 여러 작은 연구들이 진행되었다. 그러나 SSCs/ BMSCs를 사용한 조직 공학은 자가 배양 세포의 배양 기간, SSC/ BMSC의 성장과 분화를 시켜주는 무게를 차지하는 scaffold의 부재 및 전체적으로 느린 혈관 생성과 같은 이유로 정형외과에서 주목받지 못하였다. 마찬가지로, 자가 치수에서 배양된 줄기세포는 치수가 절제된 치아로 이식되었고, 방사선 증거에 기초하여 치수와 상아질이 재생되었다는 것을 확인하였다. 이 연구들은 ADA-SCID 또는 수포성표피박리증에 대한 연구와 달리, 식별할 수 있는 마커가 없기 때문에 재생된 조직이 외인성 세포에서 유래한 것인지 확인할 수 없었다. 그럼에도 불구하고, 이 연구들은 TS/ PC의 기능적 특성이 치료를 위해 활용될 수 있다는 것을 보여주었다. 이것은 앞으로의 연구에서는 전체적인 세포 특성을 완전히 파악하는 것이 필요하고, 이로 인해 검증된 줄기세포 기반의 치료법이 더욱더 발전할 수 있게 될 가능성을 보여준다.
2.5. 재생 신경과학에서 다분화성줄기세포-유래세포
태아 세포의 이식을 통한 세포 대체는 파킨스 질환, 헌팅턴 질환, 망막 퇴행성 장애 및 뇌졸중과 같은 급성 또는 진행성 신경퇴행성 질환에서 손실된 뉴런을 대체하기 위한 치료전략으로 발달되어왔다. 특히 파킨슨병에서 유망한 결과를 보였지만, 태아 조직을 세포 공급원으로 사용하는 것이 어렵기 때문에 임상용으로 쉽게 이용 가능하고 세포주 은행 형성이 가능하며 품질관리가 가능한 세포를 개발할 필요가 있다.
다분화성줄기세포(Pluripotent Stem Cells, PSC) 분화 방법의 진보는 PSC-유래세포를 임상에 더 큰 규모로 이용할 수 있게 만들었다. 현재, 척추 손상을 치료하기 위한 임상시험이 시작되었으며, 안과학에서 PSC-유래 망막생소상피세포는 연령에 관련된 황반변성환자에게 이식되었다. 두 가지 시험 모두 방법에 대한 안전성 및 가능성이 확인되었으며, 기능적 효능은 합성 기저막에서 인간 배아 줄기세포-유래 망막 상피세포를 이식한 환자에서 입증되었다. 이러한 선행 실험은 중요한 개념의 근거 자료를 제공함으로써 많은 영감을 주었으며, 또한 전임상 안전성 및 종양원성연구에 대해 논의하게 하여 신경 퇴행성 질환을 목표로 하는 재생 신경과학에서 다른 PSC-유래 생산물의 규제 승인을 위한 길을 열었다.
파킨슨 질환은 중뇌 도파민성 뉴런의 점진적인 손실을 특징으로 하는 신경 퇴행성 질환 중에서 두 번째로 흔한 질환으로, 운동을 통제하는 기능을 담당하는 선조체(striatum)에서 도파민 수치가 감소한다. 현재, 파킨슨병의 가장 흔한 치료법은 도파민 약물을 사용하여 뇌에서 도파민 수치를 높이는 것이다. 초기 단계에서는 이러한 치료법이 효과가 좋지만, 비 생리학적 또는 비국소화방식으로 전달되는 장기 투여는 운동 이상증 및 신경정신과 합병증과 같은 부작용이 생길 수 있다. 세포 치료는 손실된 도파민 뉴런을 파킨슨 선조체(putamen과 caudate)에서 국소적으로 조절된 방식으로, 도파민수치를 증가시키는 건강한 세포로 대체하는 것을 목표로 한다. 이러한 방법은 30년 전에 처음으로 태아의 복부 중뇌(foetal ventral midbrain) 조직을 파킨슨 질병을 앓고 있는 환자의 뇌의 내부에 존재하는 조가비핵(Putamen)에 이식하였다. 그 이후로 유럽, 미국과 캐나다에서 수백 명의 환자들은 태아의 복부 중뇌 이식을 받았다. 이러한 시험은 도파민 선조 신경의 회복이 실제로 파킨슨병 환자에게 장기 임상적 이점을 제공할 수 있다는 중요한 증거를 제공했다. 그러나, 이러한 시험의 결과는 경향성을 발견 하기 어려웠고, 도덕성에 대한 의문이 제기되어 왔다. 시간이 지남에 따라, 일부 이식환자들은 이식체로부터 실질적으로 장기적인 영향을 받는다는 것이 분명해졌다. 이러한 연구 결과는 이식 후 기능적으로 회복된 도파민 전송을 PET im-aging으로 확인하였고, 이식 후 수십 년 동안 뇌의 사후 분석을 통해 숙주 putamen의 광범위한 신경분 포와 이식체의 장기적인 생존을 식별하였다. 동시에, 많은 수의 환자들에서 이식에 의해 유발된 운동 이상증과 같은 부작용이나 임상적 개선 효과는 없거나 낮은 것으로 나타났다. 그리고 사후 분석 결과로 이식된 세포에서 Lewy body pathology를 밝혀냈다.
그럼에도 불구하고, 30년에 걸친 전임상과 임상시험으로 인해 파킨슨 질환에서 재생 이식 치료는 성공할 수 있음을 입증하였다. 그러나, 태아 세포를 이용한 세포 치료는 공여자 조직의 부족으로 인해 실행이 어렵다. 따라서 현재, 필요한 양을 충분히 공급할 수 있는 배양 가능한 세포 공급원이 필요하다. 가장 최선의 선택은 이식 전에 태아 복부 중뇌조직에서 얻어낸 세포들을 배양하는 것이지만, 기능적 도파민 뉴런으로 분화 가능한 분화능을 유지하면서 신경전구체로 충분히 배양하는 것은 어렵다고 입증되었다.
그러나, 1998년에 인간 배아줄기세포(human ESC) 배양과 2007년 인간 유도 만능 줄기세포(human induced PSCs)에 대한 첫 번째 보고를 통해 도파민 뉴런의 무한한 공급원에 대한 새로운 가능성이 생겨났다. 많은 초기연구들로 인해 인간 ESC로부터 도파민 뉴런과 같은 신경을 포함한 뉴런을 생성하는 데 성공한 것이다. 2010년대 초반에 중뇌 도파민 뉴런의 발달 과정을 모방한 방법은 파킨슨 질환의 전임상 모델에서 생존, 융합, 기능적 성숙된 중뇌 도파민 뉴런을 생성하였다고 보고했다. 중요하게도, 줄기세포 기반 도파민뉴런과 전구세포는 태아 복부 중뇌 조직에서 얻어낸 세포와 분자 및 기능적으로 유사하여, 이 세포들이 환자에게 사용하기에 적합하다는 근거를 제공하였다. 이러한 결과는 임상시험에 사용하기 위한 동결 보존된 도파민 전구세포를 생성하기 위한 GMP 적응 및 세포 생산체제의 개발을 가능하게 하였다. 이러한 최초의 인간 PSC 기반 시험은 1980-1990년에 실시된 태아 세포 시험과 유럽의 후원을 받아 현재 진행중인 “TRANSEURO” 이라는 임상시험을 통해 얻은 중요한 측면을 기반으로 설계되었다. 이렇게 얻어낸 정보들은 연구원들이 현재 시험에서 세포 투여, 수술 매개 변수, 환자 선택, 면역 억제 및 적절한 결과 측정법에 대해 결정함으로써 성공 가능성을 높이는 데 도움이 되고 있다.
태아 세포와 달리, 줄기세포 유래 제품은 ATM으로 규제된다는 사실과 관련하여 새로운 문제점이 드러났다. 그럼에도 불구하고, 전 세계의 많은 연구센터들이 현재, 임상 시험을 진행하고 있다. 이러한 상황에서, 여러 그룹이 함께 협력하여 전임상 평가, 제조, 안전성 및 효능 테스트가 가능한 ‘GForce-PD’를 개발하여 네트워크 내 임상 경로에 대한 빠른 추적 요법과 관련된 문제를 해결했다. 이는 파킨슨 질환 치료의 연구 발전에 대한 기대와 다른 신경 퇴행성 질환에서 새로운 재생 의학의 발전에 박차를 가할 것이다.
3. 결론
조혈 및 상피 줄기세포에서 얻은 정보들을 질병치료나 질병 완화에 도움이 될 수 있도록 통제가 가능하고, 재현이 가능한 치료 방법으로 사용하기 위해서, 거의 30년 동안 강도 높은 기초 및 임상연구가 진행되었다. 같은 기간 동안, 파킨슨 질환과 망막질환에 대한 세포 치료도 비슷한 발전을 이루었다. 이러한 성과를 위해 특정 줄기세포와 그 유도체, 계통 관계, 세포 기능, 항상성 및 질병의 신호 메커니즘에 대한 생물학적 심층 지식이 필요했다. 하지만, 이러한 지식을 얻기위해서는 적절하고 실현 가능한 임상시험 방법에 의존하였다. 혈액 및 편평 상피의 경우, 시험 방법을 비교적 쉽게 개발할 수 있었다. : 조혈 줄기세포는 정맥 내 주입에 의해 전달되는 반면, 편평 상피 배양 및 망막색소상피세포는 적절하게 준비된 신체 표면에 이식된다. 좀 더 복잡한 중추신경계통(CNS) 세포 치환은 세포 생성과 함께 개발된 신경외과적 전달 방법이 필요하다.
줄기세포 생물학에서, 복잡한 혈관 조직 또는 장기를 치료하기 위한 임상시험으로 적용하는 것은 이미 존재하는 질환 세포들을 제거하는 데 어려움이 있기 때문에 공여자의 세포가 착생하기 위한 공간을 만들어야 하므로 훨씬 더 다양한 관점에서 고려해야 한다. 예를 들어, 질병이 걸린 조혈 또는 피부 줄기세포의 제거는 쉽게 해결 가능하지만, 골격 또는 근육에서는 어려울 수 있다. 줄기세포를 기반으로 하는 치료의 경과에 대한 분석은 조혈 및 표피 줄기세포에 대한 임상시험에서 보여주었듯이 특정 줄기세포에 대해서 생물학적으로 이해하는 데 도움이 되었을 것이다. 또한, 정의된 줄기세포들을 사용하여 성공적인 결과를 낳은 임상시험을 기반으로 개발된 조건들은 현재 개발 중인 다른 줄기세포 치료나 유전자 치료에 적용하는데 많은 기여를 할 수 있을 것으로 생각된다.
줄기세포 연구
2005 제대혈 줄기세포로
성인 백혈병 이식 연속 성공
2007 줄기세포 신 배양기술인
유전자 변형 인간 배아줄기세포주 개발
2009 국내최초 체세포복제 배아줄기세포 연구 승인
국내최초 제대혈 줄기세포 이식해 뇌성마비 환자 치료
세계최초 단백질만을 이용한 역분화 줄기세포 확립성공
2010 한국인 25%에 이식 가능한 배아줄기세포주 확보
2011 국내최초 배아줄기세포치료제
스타가르트병 임상 승인
2012 세계최초 줄기세포 이용 ‘헌팅톤병’ 치료가능성 제시
국내최초 배아줄기세포 치료제
노인성 황반변성 임상 승인
2013 세계 최초 타인 제대혈 줄기세포 이용 뇌성마비 치료 성공
국내최초 배아줄기세포 유래 근시성 망막 변성 치료제 임상승인
2014 세계최초, 성인 체세포 이용한 체세포 복제 줄기세포주 확립 성공
2015 아시아 최초, 배아줄기세포 망막세포 치료제 임상 논문 발표
차병원줄기세포팀 세계 최초 체세포복제줄기세포주 성공률 획기적으로 높임
So you have finished reading the 줄기 세포 연구 topic article, if you find this article useful, please share it. Thank you very much. See more: 줄기세포 연구 찬반, 줄기세포 연구 현황, 줄기세포 역사, 줄기세포 치료, 줄기세포 연구 동향 2021, 줄기세포 연구 동향 2020, 배아줄기세포, 배아줄기세포 연구

