You are looking for information, articles, knowledge about the topic nail salons open on sunday near me 상대 휘발 도 on Google, you do not find the information you need! Here are the best content compiled and compiled by the https://toplist.pilgrimjournalist.com team, along with other related topics such as: 상대 휘발 도 Relative volatility, 헨리의 법칙, 헨리의 법칙 증명, 헨리의 법칙 문제
Table of Contents
파르데스: 상대휘발도란?
- Article author: pardeslee.blogspot.com
- Reviews from users: 37478
Ratings
- Top rated: 3.3
- Lowest rated: 1
- Summary of article content: Articles about 파르데스: 상대휘발도란? 일명 비휘발도라고도 불리는 상대휘발도가 있다. 증류는 바로 이 상대휘발도의 차이를 이용하여 물질을 분리하는 과정이다. 증기압이 온도에 대한 함수기 … …
- Most searched keywords: Whether you are looking for 파르데스: 상대휘발도란? 일명 비휘발도라고도 불리는 상대휘발도가 있다. 증류는 바로 이 상대휘발도의 차이를 이용하여 물질을 분리하는 과정이다. 증기압이 온도에 대한 함수기 …
- Table of Contents:
2017년 10월 26일 목요일
프로필
블로그 보관함
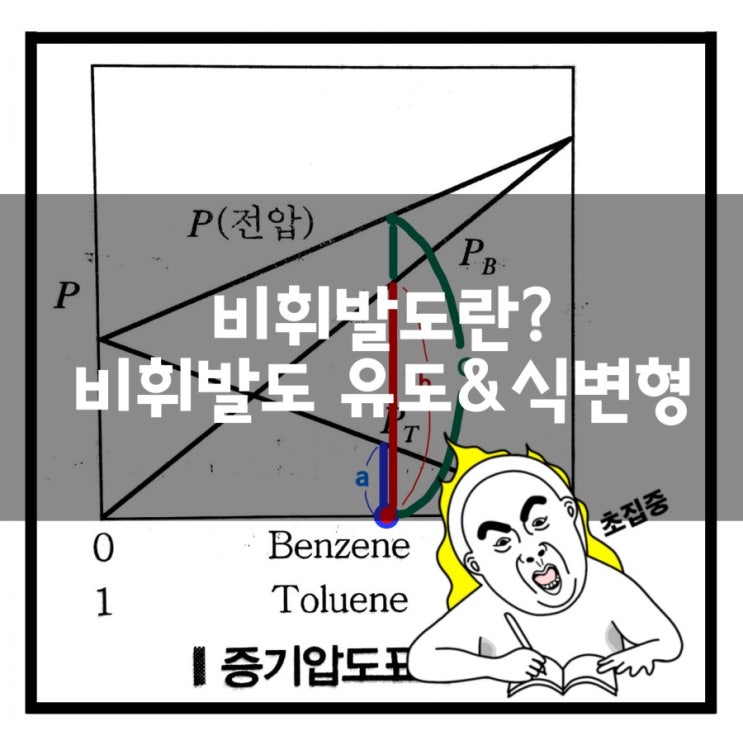
비휘발도란~? 비휘발도의 유도와 식변형~ : 네이버 블로그
- Article author: m.blog.naver.com
- Reviews from users: 15860
Ratings
- Top rated: 4.6
- Lowest rated: 1
- Summary of article content: Articles about 비휘발도란~? 비휘발도의 유도와 식변형~ : 네이버 블로그 Relative Volatility를 의미하고 상대 휘발성이라고 표현하면 이해하기 더 쉽답니다~. . . 표기는. 다음과 같이 표기를 해줘요 A의 비 휘발도를 … …
- Most searched keywords: Whether you are looking for 비휘발도란~? 비휘발도의 유도와 식변형~ : 네이버 블로그 Relative Volatility를 의미하고 상대 휘발성이라고 표현하면 이해하기 더 쉽답니다~. . . 표기는. 다음과 같이 표기를 해줘요 A의 비 휘발도를 …
- Table of Contents:
카테고리 이동
공대생 블로그
이 블로그
공대생 ▷기초화학
카테고리 글
카테고리
이 블로그
공대생 ▷기초화학
카테고리 글
게시판 > 질답게시판 > 온도에 따른 상대 휘발도
- Article author: www.chemeng.co.kr
- Reviews from users: 33769
Ratings
- Top rated: 3.1
- Lowest rated: 1
- Summary of article content: Articles about 게시판 > 질답게시판 > 온도에 따른 상대 휘발도 온도에 따른 증기압 곡선의 slope가 대부분 성분들마다 다르기 때문에 상대 휘발도 값도 온도에 따라 달라 질 것 같은데요.. 맞는지요? ^^;;. …
- Most searched keywords: Whether you are looking for 게시판 > 질답게시판 > 온도에 따른 상대 휘발도 온도에 따른 증기압 곡선의 slope가 대부분 성분들마다 다르기 때문에 상대 휘발도 값도 온도에 따라 달라 질 것 같은데요.. 맞는지요? ^^;;.
- Table of Contents:
 Read More
Read More
화공기사 실기 필답형 – 라울의 법칙, 헨리의 법칙, 비휘발도 :: 자격증 공부 블로그
- Article author: sml2756.tistory.com
- Reviews from users: 13603
Ratings
- Top rated: 4.8
- Lowest rated: 1
- Summary of article content: Articles about 화공기사 실기 필답형 – 라울의 법칙, 헨리의 법칙, 비휘발도 :: 자격증 공부 블로그 비휘발도 (Relative Volatility, 상대휘발도). – A와 B의 휘발도를 비교한 것으로 A가 B에 비해 얼마나 휘발성이 강한지를 나타내는 지표. …
- Most searched keywords: Whether you are looking for 화공기사 실기 필답형 – 라울의 법칙, 헨리의 법칙, 비휘발도 :: 자격증 공부 블로그 비휘발도 (Relative Volatility, 상대휘발도). – A와 B의 휘발도를 비교한 것으로 A가 B에 비해 얼마나 휘발성이 강한지를 나타내는 지표. 1. 라울의 법칙 (Raoult’s law) 1) 정의 – 특정 온도에서 혼합물중 한 성분의 증기분압은 그 성분의 몰분율에 같은 온도에서 그 성분의 순수한 상태에서의 증기압을 곱한 것과 같다. 2) 이상용액 (ideal Soluti..화공기사, 수질환경기사, 대기환경기사 등 자격증을 준비하는 공간입니다 : )
- Table of Contents:
1 라울의 법칙 (Raoult’s law)
2 헨리의 법칙 (Henry’s Law)
3 비휘발도 (Relative Volatility 상대휘발도)
TAG
관련글 관련글 더보기
인기포스트

상대휘발도측정 > BRIC
- Article author: www.ibric.org
- Reviews from users: 24462
Ratings
- Top rated: 4.6
- Lowest rated: 1
- Summary of article content: Articles about 상대휘발도측정 > BRIC 안녕하세요. 어떤 휘발성 액체의 상대휘발도를 측정하고 싶은데요.상대휘발도 분석해주는 곳이 따로 있을까요?선배님들의 조언 부탁드… …
- Most searched keywords: Whether you are looking for 상대휘발도측정 > BRIC 안녕하세요. 어떤 휘발성 액체의 상대휘발도를 측정하고 싶은데요.상대휘발도 분석해주는 곳이 따로 있을까요?선배님들의 조언 부탁드… 안녕하세요. 어떤 휘발성 액체의 상대휘발도를 측정하고 싶은데요.상대휘발도 분석해주는 곳이 따로 있을까요?선배님들의 조언 부탁드…BRIC, 생물학연구정보센터
- Table of Contents:
 Read More
Read More
[Unit Operation]1. Phase Equilibria in Distillation
- Article author: pardeslee.tistory.com
- Reviews from users: 15262
Ratings
- Top rated: 4.7
- Lowest rated: 1
- Summary of article content: Articles about [Unit Operation]1. Phase Equilibria in Distillation 상대휘발도 α는 아래와 같이 나타낼 수 있다. 6. 상부 distillate의 key성분과 BTM product의 key성분의 평균 상대휘발도는 다성분계 증류의 … …
- Most searched keywords: Whether you are looking for [Unit Operation]1. Phase Equilibria in Distillation 상대휘발도 α는 아래와 같이 나타낼 수 있다. 6. 상부 distillate의 key성분과 BTM product의 key성분의 평균 상대휘발도는 다성분계 증류의 … 1. 증류의 vapor-liquid 평형은 K로 나타낸다. K값은 평형을 이루는 액상과 기상의 몰분율의 비다. 2. 라울의 법칙과 달튼의 부분분압 법칙을 이용한다면, K는 total P와 순수성분의 vapor P(P˚)를 이용해서 나..
- Table of Contents:
![[Unit Operation]1. Phase Equilibria in Distillation](https://img1.daumcdn.net/thumb/R800x0/?scode=mtistory2&fname=https%3A%2F%2Ft1.daumcdn.net%2Fcfile%2Ftistory%2F99BBBC4B5A8C26A536)
[KOSEN-코센리포트]공정 향상을 위한 증류 강화 기술과 연계된 반응증류 연구 현황
- Article author: www.kosen21.org
- Reviews from users: 10639
Ratings
- Top rated: 4.5
- Lowest rated: 1
- Summary of article content: Articles about [KOSEN-코센리포트]공정 향상을 위한 증류 강화 기술과 연계된 반응증류 연구 현황 증류(distillation) 공정은 혼합 용액 성분들의 상대 휘발도(relative volatility)의 차를 이용하여 성분들을 분리하는 것을 말하며, 특히 원유(crude … …
- Most searched keywords: Whether you are looking for [KOSEN-코센리포트]공정 향상을 위한 증류 강화 기술과 연계된 반응증류 연구 현황 증류(distillation) 공정은 혼합 용액 성분들의 상대 휘발도(relative volatility)의 차를 이용하여 성분들을 분리하는 것을 말하며, 특히 원유(crude …
- Table of Contents:
전체 메뉴
동향
담당자
![[KOSEN-코센리포트]공정 향상을 위한 증류 강화 기술과 연계된 반응증류 연구 현황](https://i0.wp.com/wpsites.net/wp-content/uploads/2014/06/icon-after-more-link.png)
See more articles in the same category here: https://toplist.pilgrimjournalist.com/blog.
화공기사 실기 필답형 – 라울의 법칙, 헨리의 법칙, 비휘발도
728×90
1. 라울의 법칙 (Raoult’s law)
1) 정의
– 특정 온도에서 혼합물중 한 성분의 증기분압은 그 성분의 몰분율에 같은 온도에서 그 성분의 순수한 상태에서의 증기압을 곱한 것과 같다.
라울의 법칙 (Raoult’s law)
2) 이상용액 (ideal Solution)
– 라울의 법칙에 적용되는 용액을 말한다.
– 구조가 비슷한 것으로 이루어진 2성분계 용액은 라울의 법칙에 적용된다.
– ex) 벤젠과 톨루엔, 메탄과 에탄, 메탄올과 에탄올
cf. 돌턴(Dalton)의 분압법칙
– 증기 중 성분 A의 몰분율인 y는 전압에 대한 A의 분압의 비와 같다.
돌턴(Dalton)의 분압법칙
2. 헨리의 법칙 (Henry’s Law)
– x가 0에 근접할 때(휘발성의 용질을 포함한 묽은 용액이 기상과 평형에 있을 때), 기상 내의 용질의 분압 pA는 액상의 몰분율 xA에 비례한다. 이때의 비례상수는 헨리상수 이다.
3. 비휘발도 (Relative Volatility, 상대휘발도)
비휘발도 (Relative Volatility, 상대휘발도)
– A와 B의 휘발도를 비교한 것으로 A가 B에 비해 얼마나 휘발성이 강한지를 나타내는 지표
– 비휘발도가 클수록 증류에 의한 분리가 쉽다.
– 액상이 라울의 법칙을 따르고, 기상이 돌턴 법칙을 따른다고 가정하면 다음과 같이 정리할 수 있다.
cf. 공비점
: 한 온도에서 평형상태에 있는 증기의 조성과 액의 조성이 동일한 점
cf. 공비혼합물
: 공비점을 갖는 혼합물
[Unit Operation]1. Phase Equilibria in Distillation
1. 증류의 vapor-liquid 평형은 K로 나타낸다. K값은 평형을 이루는 액상과 기상의 몰분율의 비다.
2. 라울의 법칙과 달튼의 부분분압 법칙을 이용한다면, K는 total P와 순수성분의 vapor P(P˚)를 이용해서 나타낼 수 있다.
3. 라울의 법칙은 비슷한 Compound들끼리 있을 때, 압력이 낮을 때 유용한 approximation이 될 수 있다. (ex. parrafin w/ low boiler) 압력이 높을 수록 K는 전체압력인 P에 반비례하지 않는데 compressibility effect때문에 그렇다. 하지만 대체적으로는 아래 Depriester Chart를 보면 K값이 Total 압력에 대체적으로 반비례 함을 확인할 수 있다.
K값은 온도에도 크게 의존한다. 이것은 증기압(P˚)때문에 그렇다.
4. 다시 한번 정리하자면,
물질의 기액평형을 나타내는 평형상수 K는 온도와 압력의 함수이다.
온도가 증가하면 K도 증가하고, 압력이 증가하면 K는 감소한다. (라울과 달튼의 법칙을 만족하는 한)
5. 단일성분에서는 위와 같은 성질이 성립하지만, 두 성분의 K값의 비인 상대휘발도에서는 그 차이가 온도와 압력에 크게 바뀌지 않을 수도 있다. 상대휘발도 α는 아래와 같이 나타낼 수 있다.
6. 상부 distillate의 key성분과 BTM product의 key성분의 평균 상대휘발도는 다성분계 증류의 최소단수를 산출하는데 매우 중요한 역할을 한다.
[KOSEN-코센리포트]공정 향상을 위한 증류 강화 기술과 연계된 반응증류 연구 현황
2
항목 RD R-DWC CCD R-HiGee 공정 설계 및 모사(관련 방법과 도구의 이용 가능성) +++ +++ ++ + 공정 동적 제어(관련 방법과 도구의 이용 가능성) +++ ++ ++ + 실제적 문제(작동의 수월성) +++ ++ ++ + 적용 범위(다양한 화학반응 등) +++ ++ ++ + 기술 준비도(파일럿 플랜트 및 산업적 적용 경험) +++ ++ + 자료 없음 에너지 저감률(기존 공정 대비) 15~80% 15~75% 20~35% 자료 없음 장치비 저감률(기존 공정 대비) +++ +++ +++ +++
1. 서론증류(distillation) 공정은 혼합 용액 성분들의 상대 휘발도(relative volatility)의 차를 이용하여 성분들을 분리하는 것을 말하며, 특히 원유(crude oil)로부터 성분을 분리하는 정유 증류 공정은 석유화학 공업의 주요 분야이다. 또한 “정유공장의 화공 엔지니어는 화공의 꽃이다”라는 말이 있듯이, 화학공학 분야에서 가장 중요한 공정 중의 하나라고 할 수 있다. 반응증류(reactive distillation, RD)는 증류에 의한 분리와 화학반응이 동시에 일어나는 공정을 말하며, 다음과 같은 장점이 있다.(1) 향류 흐름을 위해 추가 장치가 필요하지 않음(2) 재순환을 위해 추가 장치가 필요하지 않음(3) 생성된 생성물이 증류를 통해 액상에서 제거됨으로써 반응평형에 제한을 받지 않고 반응이 빠르게 일어나고, 100% 전환율(conversion)이 가능(4) 반응장치와 분리장치를 하나의 장치로 만듦으로써 설치비를 획기적으로 저감시킴(5) 반응열을 액상의 성분이 증발하는 데 사용(6) 증류 공정만으로는 분리가 불가능한 공비혼합물(azeotrope)의 분리가 가능반응증류는 고체 촉매를 사용하는 경우 촉매증류(catalytic distillation)라고도 한다. 이러한 반응증류는 1920년대에 개발되어 공정효율을 크게 개선시켰으며, 가장 성공적인 공정 향상 기술 중의 하나이다. 반응증류의 공정 개선 효과를 가장 극적으로 보여주는 예가, Agreda와 Partin이 개발한 아세트산과 메탄올로부터의 메틸 아세테이트(methyl acetate) 생성 반응증류 공정이다(그림 1). 여기서 반응식은 ‘MeOH + HOAc ↔ MeOAc + HO’이며, 기존 공정은 1개의 반응기와 일련의 9개의 증류탑으로 구성되는 데 비하여 Agreda와 Partin의 공정은 1개의 탑으로 구성되며, 이 탑 안에서 증류, 반응, 추출증류(azeotropic distillation)를 모두 일어나게 하여서 100% 전환율을 달성할 수 있었으며, 장치비와 운전비가 획기적으로 저감되었다.반응증류는 이렇게 여러 장점도 있지만, 반응과 증류의 반응 조건이 겹쳐야 한다는 점, 활성도가 높고 선택적이면서도 충분히 오래가는 촉매를 사용해야 하는 제한사항이 있다. 한편, 증류 공정과 관련하여 여러 공정 강화 기술들이 개발되었으며, 이러한 기술들과 반응증류 공정을 조합하면 공정 향상도가 배가될 것이다. 이러한 맥락에서, 본 보고서에서는 그중에서도 (1) 분리벽형 탑(divid-ing wall column, DWC), (2) 사이클 증류(cyclic distillation), (3) HiGee 증류(HiGee distillation)의 공정 기술과 연계된 반응증류 공정에 대하여 그 특성과 장점, 한계점 등을 알아보았다.2. 반응증류 공정과 연계된 공정 강화 기술2.1. 분리벽형 탑분리벽형 탑 기술은 산업적으로 매우 응용 가능성이 높고 규모 확장이 용이하기 때문에 활발히 연구개발되는 분야이다. 이러한 DWC는 증류탑과 보조탑의 조합인 Petlyuk 증류탑과 동등한 장치로서, 기존의 증류탑에 비하여 (1) 분리 효율이 좋고, (2) 배출 생성물의 순도가 높으며, (3) 장치비와 설치 공간이 적게 드는 한편, (4) 추가로 냉각기, 가열기 설치가 필요 없다는 장점이 있다. 이러한 DWC와 반응증류를 결합(R-DWC)하면 공정 개선의 상승효과를 기대할 수 있다. 예를 들면, 메틸 데카노에이트(methyl decanoate, MeDC)는 메틸 에스테르의 한 종류로서, 데칸산(decanoic acid)과 메탄올의 에스테르화반응으로 생성된다. 이러한 MeDC의 제조공정은 MeDC 생성 반응과, 생성 혼합물로부터의 MeDC의 증류 분리 반응으로 이루어진다. 이때, MeDC 생성 반응의 반응물인 메탄올은 저비점 화합물로서 휘발성이 강하며, 이는 액상에서의 농도를 낮추어서 반응속도 저하와 반응평형의 저해 요인이 된다. 따라서 반응증류탑 내의 일정 영역에 분리벽(dividing-wall)을 설치하는 것이 하나의 개선 방안이 될 수 있다(그림 2).2.2. 촉매 사이클 증류사이클 증류는 내부의 작동 모드를 주기적으로 변경함으로써, 각각의 분리상(separate phase) 흐름을 정한 시간 간격으로 변경하여서, 기상흐름 기간(gas-flow period, VFP)와 액상흐름 기간(liquid-flow period, LFP)이 있게 하는 증류 방법이다(그림 3). 이 방법은 액체흐름을 정지 기간과 흐름 기간으로 나누어지게 하여서, 각 단에서의 기상과 액상 사이 이동의 구동력(driving force)을 최대화하고 다른 조성의 액체들의 혼합을 최소화하려는 데에 그 목적이 있다. VFP와 LFP의 흐름 모드는 타이머를 사용하여, 재비기(reboiler)와 증류탑을 연결하는 기상흐름 밸브를 제어함으로써 구현할 수 있다. 또한 사이클 증류는 하강관(downcomer)이 없어서 단(plate)의 구조를 간단히 할 수 있으며, 따라서 저가의 유연한 단을 사용할 수 있다. 사이클 증류에서는 판(tray) 아래에 수문(sluice)이 있는 특별한 판(그림 3)을 사용한다. LFP에서는 수문을 끌어올릴 수 있을 정도의 기상흐름이 없어서, 액체가 있는 위 판의 수문이 열리며 기체가 통과하는 아래 판의 수문은 닫히게 된다. 따라서 기상흐름은 완전히 차단되며, 액상흐름만 있게 된다. 반대로, VFP에서는 기상흐름이 수문을 끌어올려 위판 수문이 닫히고 아래 판 수문이 열려서 기상흐름만 있게 된다. 이러한 구조의 단 구조는 단의 개수와 무관하게 사이클 증류에 사용할 수 있다는 것은 주목할 만하다.반응증류와 결합된 사이클 증류 공정, 즉 촉매 사이클 증류(catalytic cyclic distillation, CCD)는 흥미로운 공정 강화 기술이며, Partrut와 연구자들의 연구 결과에 의하면, 기존 RD에 비하여 더 적은 단수와 낮은 기상흐름 속도에서 훨씬 더 높은 순도의 배출물을 얻을 수 있었다. 또한 더 유연한 공정 운용이 가능한데, 이는 사이클 증류가 기존 RD 공정보다 더 순도 범위가 넓은 배출물을 가질 수 있기 때문이다. 결과적으로, CCD는 기존 RD보다 에너지는 더 적게 요구되면서 더 높은 순도의 배출물을 얻을 수 있으며, 더 높은 촉매 또는 액상 holdup 대 공간 비율을 가질 수 있다.2.3. HiGee 증류HiGee 증류(high gravity distillation, HiGee distillation)는 원심력을 부가하여 높은 중력장을 유체에 부가함으로써, 분별증류 효율을 높이는 최신 증류 기술 기법이다. HiGee 증류와 반응증류 공정을 결합(R-HiGee)할 경우 100~1,000g의 높은 중력장에서는 범람 속도를 높일 수 있으며, 더 넓은 표면적의 밀한(dense) 충전(packing)이 가능하다. 회전충전층(rotating packed bed, RPB)(그림 4)의 경우는, 이론단상당높이(height equivalent to theoretical plate, HETP)가 2~8cm이었다. 1999 년 에 Dow 케미칼은 RPB의 산업화의 성공적 예 중의 하나인, 차아염소산(hypochlorous acid)의 반응탈거(reactive stripping) 공정을 소개하였다. 또한 Krishina와 연구자들은 R-HiGee의 모델을 개발하고, 실제 공정에 적용 분석하였으며, 메틸 락테이트(methyl lactate)의 가수분해를 위한 HiGree 탈거-막 공정(stripping-membrane process)에서의 공정 최적화(process optimization)를 수행하였다. Gudena와 연구자들은, 옥틸-헥사노에이트(octyl-hexanoate)의 생산공정에서 동시에 일어나는, 고체 촉매 기반 반응탈거와 수분 제거 반응에 관하여 보고하였다. 아직 고체 촉매를 사용한 R-HiGee 공정의 연구 결과는 많지 않지만(few), 향상된 기액 물질전달 속도와 높은 중력장에 힘입어 가능한 촉매의 우수한 젖음(wetting) 성질은, R-Higee 공정의 상업적 응용 성공의 가능성이 매우 높음을 알려준다.2.4. 다양한 공정 강화 기술과 연계된 반응증류 기술의 비교표 1에서, 앞에서 논의된 공정 강화 기술과 연계된 반응증류 기술들의 특성을 상호 비교하였으며, 산업적/학술적 현장 및 연구 경험과 문헌 정보에 기초하였다. 이러한 기술들은 모두 매우 유망한 공정 기술들이지만, 산업적 응용에서의 적합한(niche) 분야는 서로 다르며 기술개발 단계도 상이하다.이 중에서, 특히 DWC의 성공에 기초한 R-DWC와 CCD는 산업적 응용 가능성이 매우 높다. 반면에, R-HiGee는 장치 크기를 획기적으로 축소시킬 수 있으나 에너지 절감효과가 크지 않은 단점을 지니고 있다.3. 결론다른 증류 강화 기술과 연계된 반응증류 기술은, 향후 자원-, 에너지-, 비용- 면에서 효율적인화합물 생산공정으로서 매우 유망하지만, 아직 이에 대한 연구가 미비한 실정이다. 따라서 관련 종사자들의 연구개발, 특히 실험적/파일럿 플랜트 규모의 연구가 활발히 이루어지길 기대한다.1. Kiss, A., Jobson, M. Taking reactive distillation to the next level of process intensification. Chem Eng Trans,, 2018.2. Bildea, C. et al. Cyclic distillation technology – a mini-review. J Chem Technol Biotechnol,(5), 1215-1223, 2016.3. Doherty, M., Malone, M. Recent advances in reactive distillation. AIChE, annual meeting Dallas, Dallas, 3 Nov 1999.4. Agreda, V., Partin, L., Heise, W. High-purity methyl acetate via reactive distillation, Chem Eng Prog,, 40-46, 1990.5. Jhon, Y., Lee, T. Dynamic simulation for reactive distillation with ETBE synthesis. Sep Purif Technol,(3), 301-317, 2003.6. Patrut, C., Bildea, Cl, Kiss, A. Catalytic cyclic distillation – a novel process intensification approach in reactive separations. Chem Eng Process,, 1-12, 2014.7. www.fvt.bci.tu-dortmund.de/cms/en (technische universitat dortmund의 FVT사이트)
So you have finished reading the 상대 휘발 도 topic article, if you find this article useful, please share it. Thank you very much. See more: Relative volatility, 헨리의 법칙, 헨리의 법칙 증명, 헨리의 법칙 문제

